周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
已知 | 方法 | 结论 | |
A | 沸点: | 类比 | 沸点: |
B | 酸性: | 类比 | 酸性: |
C | 金属性: | 推理 | 氧化性: |
D |
| 推理 | 溶解度: |

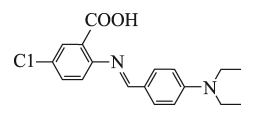
化学键 | |||||||
键能/ | 411 | 318 | 799 | 358 | 452 | 346 | 222 |
已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。


针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
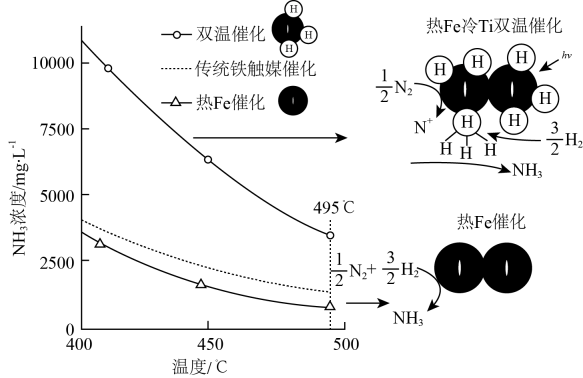
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

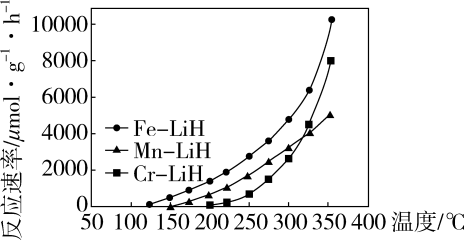
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
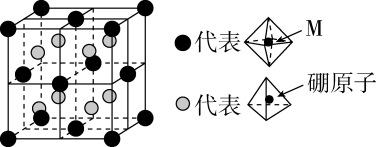
含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
A. B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。

①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
,
),则B原子的坐标为。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液



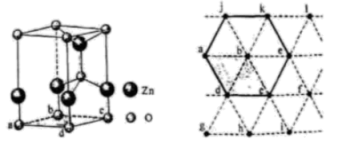
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
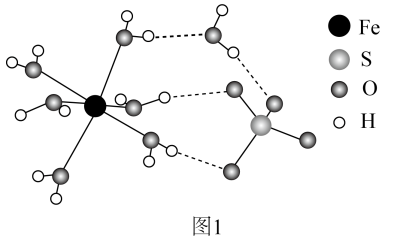
①的价层电子排布式为。
②中O和
中S均为
杂化,比较
中
键角和
中
键角的大小并解释原因。
③中
与
与
的作用力类型分别是。
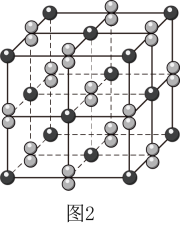
①距离最近的阴离子有个。
②的摩尔质量为
, 阿伏加德罗常数为
。
该晶体的密度为。
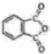 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(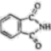 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
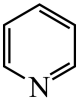 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的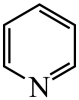 、
、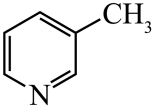 、
、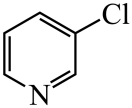 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:

①基态 原子的核外电子排布式为
;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子
离子(填“>”“<”或“=”),原因是。

①富马酸分子中 键与
键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。

①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。

①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、
。阿伏加德罗常数的值为
,则该晶体的密度为
(列出计算式)。

研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
的立体构型为。

①X的化学式为。
②设X的最简式的式量为 ,晶体密度为
,则X中相邻K之间的最短距离为
(列出计算式,
为阿伏加德罗常数的值)。
卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
a. b.
c.
d.
②一氯乙烷、一氯乙烯
、一氯乙炔
分子中,
键长的顺序是,理由:(ⅰ)C的杂化轨道中s成分越多,形成的
键越强;(ⅱ)。

已知阿伏加德罗常数为 , 则
晶体的摩尔体积
(列出算式)。
物质 | HCON(CH3)2 | HCONH2 |
相对分子质量 | 73 | 45 |
沸点/℃ | 153 | 220 |
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是。
物质 | CF4 | SiF4 | BF3 | AlF3 |
熔点/℃ | -183 | -90 | -127 | >1000 |
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是。