 B .
B .  C .
C .  D .
D . 
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究乙醇消去反应的产物 | 取 | 若溴水褪色,则乙醇消去反应的产物为乙烯 |
| B | 探究乙酰水杨酸样品中是否含有水杨酸 | 取少量样品,加入 | 若有紫色沉淀生成,则该产品中含有水杨酸 |
| C | 探究金属钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入 | 若无气体生成,则固体粉末为 |
| D | 探究 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 | 若有白色沉淀产生,则样品已经变质 |
 B .
B . 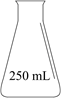 D .
D . | 选项 | 操作或做法 | 目的 |
| A | 将铜丝插入浓硝酸中 | 制备 |
| B | 将密闭烧瓶中的 | 探究温度对平衡移动的影响 |
| C | 将溴水滴入 | 萃取溶液中生成的碘 |
| D | 实验结束,将剩余 | 节约试剂 |
| 气体 | 方法 | |
| A | 氨气 | 加热氯化铵固体 |
| B | 二氧化氮 | 将铝片加到冷浓硝酸中 |
| C | 硫化氢 | 向硫化钠固体滴加浓硫酸 |
| D | 氧气 | 加热氯酸钾和二氧化锰的混合物 |
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有NO | 取少量该溶液于试管中,加稀盐酸酸化,再加入FeCl2溶液 | 若溶液变黄色且试管上部产生红棕色气体,则该溶液中含有NO |
| B | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol·L-1KI溶液于试管中,加入1 mL 0.1 mol·L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 判断某卤代烃中的卤素 | 取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液 | 若产生的沉淀为白色,则该卤代烃中含有氯元素 |
| D | 探究蔗糖在酸性水溶液中的稳定性 | 取2mL20%的蔗糖溶液于试管中,加入适量稀 H2SO4后水浴加热5 min;再加入适量新制Cu(OH)2悬浊液并加热 | 若没有生成砖红色沉淀 ,则蔗糖在酸性水溶液中稳定 |
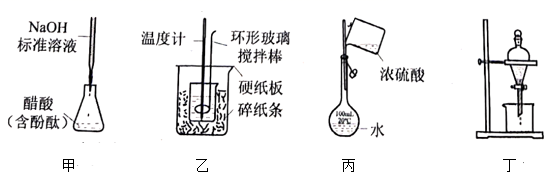
① ,合适反应温度为
;副反应:
。
②常压下, 沸点
,熔点
;
沸点2.0℃,熔点
。
③ ,
在
中的溶解度远大于其在水中的溶解度。
请回答:

②将上图中装置组装完整,虚框D中应选用。

针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→→→e→d→f→。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和 转入分液漏斗
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
实验数据如下表:
| 加入量 | |
| 滴定Ⅰ测出量 | |
| 滴定Ⅱ测出量 | |
①用标准 溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是。
②高纯度 浓溶液中要求
(
和
均以
计)。结合数据分析所制备的
浓溶液是否符合要求。

①实验任务。通过测定溶液电导率,探究温度对 溶解度的影响。
②查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时, 。
③提出猜想。
猜想a:较高温度的 饱和溶液的电导率较大。
猜想b: 在水中的溶解度
。
④设计实验、验证猜想。取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的 饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/ |
| 1 | Ⅰ:25℃的 | 25 | |
| 2 | Ⅱ:35℃的 | 35 | |
| 3 | Ⅲ:45℃的 | 45 | |
⑤数据分析、交流讨论。25℃的 饱和溶液中,
。
实验结果为 。小组同学认为,此结果可以证明③中的猜想
成立,但不足以证明猜想
成立。结合②中信息,猜想
不足以成立的理由有。
⑥优化实验。小组同学为进一步验证猜想 ,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表中内容。
| 实验序号 | 试样 | 测试温度/℃ | 电导率/ |
| 4 | Ⅰ |
| |
| 5 |
|
| |
⑦实验总结。根据实验1~5的结果,并结合②中信息,小组同学认为猜想 也成立。猜想
成立的判断依据是。
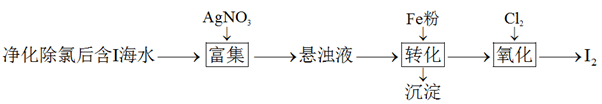
①加入 粉进行转化反应的离子方程式为,生成的沉淀与硝酸反应,生成后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为;若反应物用量比
时,氧化产物为;当
,单质碘的收率会降低,原因是。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注。大豆素的合成及其衍生化的一种工艺路线如下:

回答下列问题:
a.含苯环的醛、酮
b.不含过氧键( )
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1

步骤I. 的制备
 步骤Ⅱ.产品中
步骤Ⅱ.产品中 含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
;
④平行测定三次, 平均值为22.45,
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
| 温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| | 11.9 | 15.8 | 21.0 | 27.0 | |||
| | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
 C .
C .  D .
D . 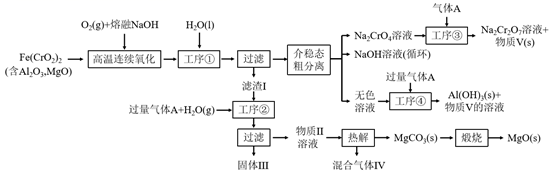
回答下列问题:
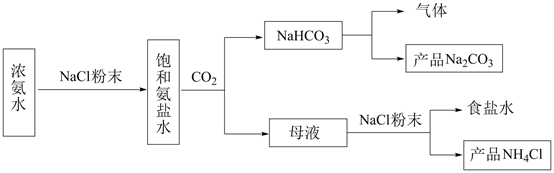
回答下列问题:
A. 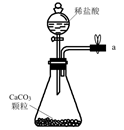 B.
B. 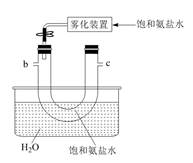 C.
C.  D.
D. 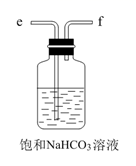 E.
E. 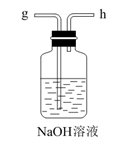
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
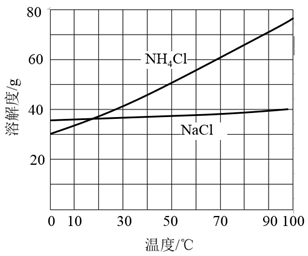
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。

该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全(c=1.0×10*mol-L')的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:

I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
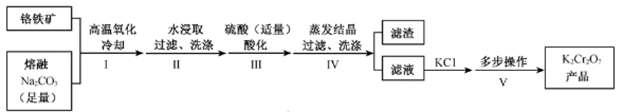
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
Cr2O
+H2O
相关物质的溶解度随温度变化如下图。
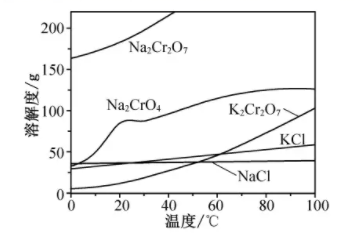
请回答:
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)