 B .
B .  C .
C .  D .
D . 
 C . 铝原子的结构示意图:
C . 铝原子的结构示意图: 

①
②
③
④
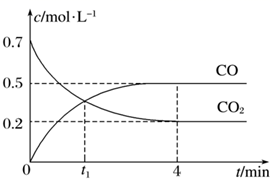
| t/s | 0 | 600 | 1200 | 1710 | 2220 | 2820 | x |
| c(N2O5)/(mol·L-1) | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 1.0 | 1.3 | 1.8 | 2.7 |


| 目的 | 方案设计 | 现象和结论 | |
| A | 检验淀粉是否已经发生水解 | 将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH)2 , 加热,没有砖红色沉淀产生 | 淀粉未发生水解 |
| B | 探究KI与FeCl3反应的限度 | 取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| C | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液 | 若有白色沉淀产生, 则样品已经变质 |
| D | 检验气体Y | 用湿润的淀粉碘化钾试纸检验气体Y, | 试纸变蓝色,Y一定是Cl2 |
a.CO b.ClO- c.CH3COO- d.HCO
a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=2ClO-+CO2↑+H2O
d.2ClO-+CO2+H2O=CO +2HClO
a. b.
c.

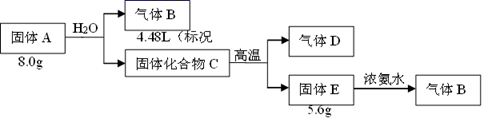
![]()
将KClO3和KOH固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入MnO2粉末,不断搅拌,呈颗粒状后,再加强热10min得墨绿色产物(K2MnO4为墨绿色固体),冷却。
①制K2MnO4反应的化学方程式为。
②本实验中使用的坩埚及搅拌棒的材质可以是。
A.石英 B.刚玉(氧化铝) C.铁(表面有致密的氧化膜)
称取mgKMnO4粗品,加入煮沸并冷却后的稀硫酸配成V0mL溶液。量取V1mLc1mol/L的草酸(H2C2O4)溶液于锥形瓶中,用所配KMnO4溶液进行滴定。重复滴定两次,平均消耗KMnO4溶液的体积为V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是。
②滴定终点的标志是。
③KMnO4纯度(质量分数)的计算式为。
![]() (g)
(g)
![]() (g)+H2(g)
(g)+H2(g)

