 B .
B .  C .
C .  D .
D . 

 B . 滴加液体
B . 滴加液体 C . 闻气体气味
C . 闻气体气味 D . 稀释浓硫酸
D . 稀释浓硫酸

选项 | 实验目的 | 实验方案 |
A | 鉴别NaOH、NH4NO3、NaCl三种白色固体 | 取样,加入等量的水充分搅拌,测量温度 |
B | 检验氢氧化钠是否变质 | 取样,加入过量稀盐酸,观察现象 |
C | 配制溶质质量分数为10%的氯化钠溶液100g | 称取氯化钠10g,加入90g水,搅拌 |
D | 除去氧化钙中的碳酸钙 | 加足量水,充分搅拌后过滤 |



A.用作建筑材料 B.制洗涤剂 C.切割大理石
①在℃时,氯化钠和碳酸钠的溶解度相等。
②20℃时,向水中加入
碳酸钠固体,充分搅拌后,可得到碳酸钠的(填“饱和”或“不饱和”)溶液。
③若碳酸钠中含有少量的氯化钠,可用结晶的方法提纯碳酸钠。


①人体中含量(质量分数)最高的元素是(填“O”或“”);
②2个氧分子;
③钙离子;
④过氧化钙中钙元素为价,氧元素为
价,过氧化钙的化学式是。

①设备1中采用喷淋法将液态硫以微小液滴的形式加入设备的目的是。
②设备2中发生的反应,其基本反应类型为反应。
③写出设备4中发生反应的化学方程式。
②自行车链条的防锈措施是。

①气体M是(填化学式)。
②四种金属活动性由强到弱的顺序是。
③固体丁中所含金属的组成情况有种。

①先将导管移出水面,再熄灭酒精灯 ②先熄灭酒精灯,再将导管移出水面

①不能燃烧 ②不支持燃烧 ③密度比空气大
已知:碱石灰是和
的固体混合物。碳酸钾与稀硫酸发生反应的化学方程式为:
。

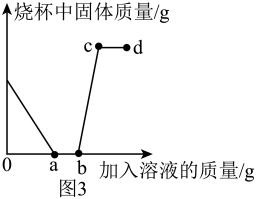
①称取质量为m克的草木灰样品,实验测得丙装置增重n克,则样品中的质量分数为(用含m、n的代数式表示)。
②充分反应后,打开弹簧夹,向装置中通入一段时间氮气。若没有此操作,会导致所测定的草木灰样品中的质量分数(填“偏小”或“偏大”或“不变”)。
【实验原理】
【实验探究】实验Ⅰ:取质量比为的木炭粉和氧化铜混合物进行实验,根据实验现象对实验效果进行评分(评分越高,效果越好)。
装置序号 | A | B |
装置 |
|
|
实验现象 | 黑色固体中有极少量 红色固体 | 出现红热现象,黑色固体 中有少量红色固体 |
实验效果评分 | 3.5 | 4.1 |
实验Ⅱ:化学兴趣小组的同学在查阅资料后提出了猜想:木炭粉和氧化铜的质量比、木炭的颗粒大小会影响实验效果。于是用实验Ⅰ中效果较好的装置再次进行了实验,根据实验现象对实验效果进行评分。
实验组 | 第一组 | 第二组 | ||||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
木炭粉和氧化铜的质量比 | | | | | | | | |
木炭颗粒 | 细 | 细 | 细 | 细 | 极细 | 极细 | 极细 | 极细 |
实验效果评分 | 6.3 | 6.9 | 5.1 | 3.8 | 7.8 | 9.2 | 6.8 | 4.0 |
通过实验组合____(填标号)可得到结论:木炭粉和氧化铜质量比为时效果最好。
碳还原氧化铜得到的铜中可能含有氧化亚铜,氧化亚铜为红色固体,能与稀硫酸反应:。化学兴趣小组的同学们为验证反应所得红色固体中是否含有氧化亚铜,取一定量红色固体样品,加入足量的稀硫酸,观察到(填写实验现象),说明所得红色固体中含有氧化亚铜。