 B . 贴对联
B . 贴对联 C . 剪窗花
C . 剪窗花 D . 包饺子
D . 包饺子
 B .
B .  C .
C .  D .
D . 
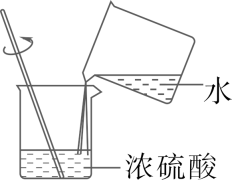 B . 铁丝在氧气中燃烧
B . 铁丝在氧气中燃烧 C . 检查气密性
C . 检查气密性 D . 测定某溶液的pH
D . 测定某溶液的pH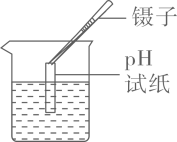
实验序号 | ① | ② | ③ | ④ | ⑤ |
氯化钠质量/g | 9 | 18 | 27 | 36 | 45 |
溶液质量/g | 109 | 118 | 127 | 136 | 136 |
下列分析正确的是( )
项目 | 每100g | 营养素参考值% |
能量 | 1468kJ | 18% |
蛋白质 | 7.5g | 13% |
脂肪 | 0.7g | 1% |
碳水化合物 | 77.3g | 26% |
钠 | 0mg | 0% |

下列说法正确的是( )




元素名称 | 氮 | 氟 | 镁 |
原子结构示意图 |
|
|
|
①上表中x=。
②镁原子失去两个电子所形成离子的离子符号为。
③已知这三种原子的核外电子层数越多,原子半径越大;核外电子层数相等时,核电荷数越多,原子半径越小。这三种原子中半径最小的是。

①物质X的化学式是。
②NH3和O2在一定条件下反应生成N2和H2O,生成的N2和H2O的分子个数之比为。
③写出HNO3通过中和反应生成Ca(NO3)2的化学方程式。


原理为:第一步,
第二步,过氧化氢分解。
①图2装置类似于图1装置中的(填“A”或“B”)。因为氧气(填“不易溶”或“可溶”)于水,氧气能从加湿过滤仓中逸出。

【提出问题】烧杯D中上层清液含有哪些溶质(除指示剂外)?
【分析讨论】小组讨论后认为,确定反应后物质成分的思维路径:①考虑反应物用量的不同;
②抓住化学反应的本质,即微粒的重组。某小组同学分析过程笔记如下:

【初步结论】
通过分析确定:烧杯D上层清液中肯定不含H+ , 肯定含有Na+、Cl-。判断肯定不含H+依据是;
【实验探究】
小组按如下方案进行实验探究
实验 | 实验内容 | 实验现象 | 实验结论 |
Ⅰ | 取少量上层清液于试管中 加入过量碳酸钠溶液,静置 | 无沉淀,溶液呈红色 | 肯定没有 |
Ⅱ | 取少量上层清液于试管中 加入过量“?”溶液,静置 | 有白色沉淀,溶液呈红色 | 肯定有OH-、 |
根据实验Ⅰ可以初步推断溶液中不含(填离子符号):上层清液中溶质(除指示剂外)可能的组成:①NaCl、NaOH;②(用化学式表示);③NaCl、NaOH、Na2CO3;
实验Ⅱ中应加入过量的溶液。
【实验结论】烧杯D中上层清液的溶质有指示剂、氯化钠、氢氧化钠、碳酸钠。
②该方法除了用于海水淡化,还可用于。
A.硬水软化 B.污水处理 C.物质鉴别
| 氯化钠 | 氯化镁 | 硫酸镁 | 硫酸钙 |
淡水 | 0.17 | 0.012 | 4.8×10-9 | 8.5×10-9 |
浓盐水 | 45.0 | 3.6 | 3.3 | 0.14 |

①写出生成Mg(OH)2的反应方程式。
②浓盐水经过步骤1和2两步反应后又获得了MgCl2 , 设计这两步的目的是。
③图中未涉及的反应类型为。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
④镁在空气中燃烧发出耀眼白光,依据此现象可用镁制作(写出一种即可)。