具体步骤如下:
Ⅰ.称取 , 用
水溶解。
Ⅱ.分批加入后,将溶液温度降至
以下,加入
活性炭、
浓氨水,搅拌下逐滴加入
的双氧水。
Ⅲ.加热至反应
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
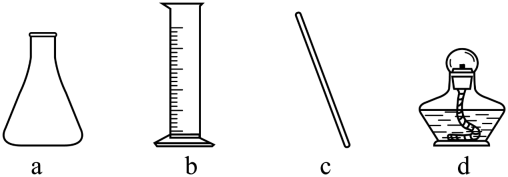
仪器a的名称是。加快NH4Cl溶解的操作有。

①先向溶液中加入过量的试剂X,试剂X是(填化学式)。
②经过(填操作名称),取滤液,然后加入过量的试剂Y,试剂Y是(填化学式)。
③该过程主要利用了氢氧化铝的两性。请写出氢氧化铝的电离方程式:。
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗

b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化

①取新制的氯水加入硝酸酸化的AgNO3溶液出现白色沉淀,证明有Cl-存在,反应的离子方程式为。
②取新制的氯水加入试剂,现象为,证明溶液中含有H+;
③取新制的氯水,加入几滴紫色的石蕊试液,溶液先变红后褪色,原因是。
a.锌的密度b.镀锌铁片质量c.纯铁片质量d.镀锌铁片面积e.镀锌铁片厚度
步骤一:先粗配浓度约为 的
溶液;
步骤二:称取草酸钠固体mg放入锥形瓶中,加入适量水溶解并加硫酸酸化,加热到70~80℃,立即用 滴定,从而标定
溶液浓度为
;
步骤三:称取样品2.352g,放入锥形瓶并用适量水溶解,然后分成三等份;
步骤四:用标准 溶液滴定步骤三所配样品溶液。三次实验达到终点时消耗标准液平均体积为20.00mL。
①步骤一中至少需要用到的玻璃仪器有烧杯、、玻璃棒。
②步骤二中需要对m的值进行预估,你的预估依据是(填标号)。
A.所加硫酸的体积和浓度
B.反应的定量关系
C.滴定管的最大容量
D.用于溶解草酸钠的水的体积
③实验过程中需要进行多次滴定,在滴定步骤前要进行一系列操作,请选择合适的编号,
按正确的顺序排列:a→→f。
a.将滴定管内装满水,直立于滴定管夹上约2min
b.用蒸馏水洗涤滴定管
c.向酸式滴定管中装入操作液至“0”刻度以上
d.用操作溶液润洗滴定管
e.将活塞旋转180°后,再次观察
f.将滴定管直立于滴定管夹上,静置1min左右,读数
g.右手拿住滴定管使其倾斜30°,左手迅速打开活塞
④在滴定接近终点时,使用“半滴操作”可提高测量的准确度。其方法是将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
⑤样品中铁元素的质量分数为。


已知:与冷的NaOH溶液反应生成NaClO,与热的NaOH溶液反应生成
。
回答下列问题:
A.二氧化锰 B.重铬酸钾 C.氯酸钾 D.浓硫酸
①称取a g样品溶于蒸馏水,配成500mL溶液;
②量取25.00mL待测液于锥形瓶中,滴入足量KI溶液,此时溶液呈棕色;
③滴入3滴5%淀粉溶液,然后用的
溶液滴定;
滴定终点的现象是;平行滴定三次,平均消耗溶液,则产品的纯度为(用含a、M的代数式表示)。(已知:
)

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象。
①含有的杂质是。
②从操作上分析引入杂质的原因是。
|
金属离子 |
pH |
|
|
开始沉淀 |
完全沉淀 |
|
|
Al3+ |
3.0 |
4.7 |
|
Fe3+ |
1.1 |
2.8 |
|
Ca2+ |
11.3 |
- |
|
Mg2+ |
8.4 |
10.9 |
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→()→()→()→()→()→()→MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤

查阅资料可知:
①;
。
②NO能被酸性氧化成
。
③暴露在空气中容易被氧化。

温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100g | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
则由溶液制得
晶体的方法为:。最后过滤洗涤干燥。常温下,若
溶液的pH控制不当会使
沉淀,当调节溶液的
时,溶液中
mol⋅L
。(常温下
).

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
在三颈烧瓶a中加入
质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应。
回答下列问题:
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒