
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 0.18 | 0.16 | 0.14 | 0.11 | 0.09 |
根据表中信息,判断下列说法不正确的是( )



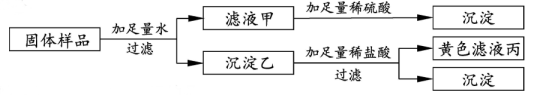
|
试剂 |
试管甲 |
试管乙 |
试管丙 |
|
加蒸馏水/现象 |
无色澄清 |
无色澄清 |
无色澄清 |
|
加无色酚酞溶液/现象 |
无明显变化 |
无明显变化 |
溶液变红色 |
|
加入硝酸银溶液/现象 |
无明显变化 |
白色沉淀 |
/ |
根据上述实验现象判断(表格中“/”表示没有加入),甲、乙、丙试管所加入的白色固体物质依
次是( )


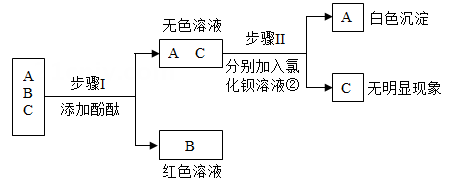
猜想一:溶质是CaCl2和Ca(OH)2
猜想二:溶质是CaCl2
猜想三:溶质是CaCl2和 .
②有关的化学反应:
a.氢氧化钙溶液和稀盐酸进行中和反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O
b.碳酸钠溶液和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
c.碳酸钠溶液和氯化钙溶液反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl
【实验设计与验证】
小猛同学设计用无色酚酞溶液验证“猜想一”是否成立.取少量上述实验中烧杯里的溶液于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到溶液不变色.于是可以确定“猜想一”(填“成立”或“不成立”),其理由是 .
经过同学们讨论和交流,发现只需用下列一种物质就能验证得出以上三种猜想中的哪一种猜想成立,请在下列物质的选项中选择出你认为合理的物质是________ (填序号).

【提出问题】该瓶粉末的成分是什么?
猜想二:该瓶粉末的成分可能为氢氧化钙和碳酸钙
猜想三:该瓶粉末的成分可能为 , 做出猜想三的理由是 .
| 实验步骤 | 实验现象 | 实验结论 | 猜想二正确 |
| ⑴取少量样品于小烧杯中,加入适量水,充分搅拌,过滤,取少量滤渣于试管中,加入 . | 有大量气泡产生 | 说明含有 | |
| ⑵取步骤⑴中的于试管中,滴加无色酚酞溶液. |
| 说明含有 |
猜想一:氢氧化钙溶液与二氧化碳不反应,是二氧化碳溶于水导致瓶内气压变小而变瘪。
猜想二:氢氧化钙溶液与二氧化碳反应,生成了可溶性物质。
|
实验 |
步骤与操作 |
出实验现象与结果 |
结论 |
|
一 |
1.取2个相同的软塑料瓶,分别集满二氧化碳气体,编号为A、B。 |
两瓶内气体无色透明,瓶子形状正常 |
氢氧化钙溶液与二氧化碳发生了化学反应 |
|
分别向A、B两瓶中加入等量的饱和氢氧化钙溶液和 ? , 立即拧紧瓶盖并振荡。 |
两瓶内液体未出现浑浊,两瓶均变瘪,A瓶变瘪程度更大。 |
||
|
二 |
测出反应前氢氧化钙溶液的酸碱度。 |
偏碱性。 |
|
|
测出反应后A瓶内液体的酸碱度。 |
偏酸性。 |
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
|
稀硫酸的用量/克 |
25 |
25 |
25 |
25 |
25 |
25 |
|
剩余固体的质量/克 |
75 |
100 |
125 |
150 |
172.8 |
197.8 |

【实验目的】检验氢氧化钠溶液中是否含有氢氧化钙。
|
实验操作 |
现象 |
结论 |
|
|
方案一 |
取少量待测溶液于试管中,通入CO2 |
出现白色沉淀 |
氢氧化钠溶液中含有氢氧化钙 |
|
方案二 |
取少量待测溶液于试管中,滴加Na2CO3溶液 |
出现白色沉淀 |
【方法感悟】在检验物质时,要分析物质的组成和性质,据此选择加入恰当的试剂,最后根据不同现象得出结论。
①将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水多少?
②样品中氢氧化钠的质量分数。