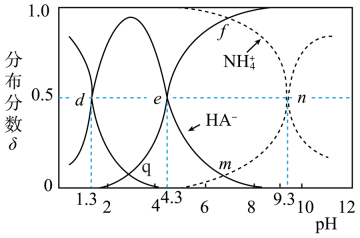
①水②Na2CO3溶液③Na2SO4溶液④CH3COONa溶液⑤少量K2SO4固体⑥几滴CuSO4溶液




NaxC+Na1-xMnO2C+NaMnO2 , 下列说法不正确的是

| 方案设计 | 现象 | 结论 | |
| A | 取一定量未知溶液于试管中,滴入浓NaOH溶液并加热 | 试管口放置的湿润红色石蕊试纸变蓝 | 该溶液的溶质属于铵盐 |
| B | 向FeCl3+3KSCN | 溶液红色变浅 | 增加生成物浓度,平衡逆向移动 |
| C | 测定等浓度Na2CO3溶液和Na2SO3溶液的pH | pH:Na2CO3溶液>Na2SO3溶液 | 非金属性:S>C |
| D | 向0.1mol/LH2O2溶液中滴加几滴0.1mol/LKMnO4溶液 | 紫色褪去 | H2O2具有还原性 |

Ⅱ.利用图2装置进行中和热测定

②处理数据得到平均温度变化量Δt=3.2℃;
③Q=cmΔt。
设盐酸和NaOH溶液的密度均为1g·cm-3 , 反应后溶液的比热容c=4.18J/(g·℃)
请计算:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=kJ/mol(结果保留一位小数)。
反应原理为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O=2I-+S4O
步骤如下:
步骤①称取20.000g市售食盐,在容量瓶中配制成100mL溶液;
步骤②取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液。
步骤③向锥形瓶中滴加指示剂,用Na2S2O3溶液滴定步骤②所得溶液。平行滴定3次。
选出正确操作并排序检查是否漏水→蒸馏水洗涤→→→a→→→。
a.加液至“0”刻度以上2~3mL处
b.调整液面至“0”刻度或“0”刻度下方,记录读数V₁
c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加3~5mLNa2S2O3标准液
f.向酸式滴定管中加3~5mLNa2S2O3标准液
g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)

已知:①流程中一系列操作包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4;与FeSO4溶液中溶质的物质的量相等。
A.测得晶体X分子量为392,则其化学式可能为(NH4)2Fe(SO4)2·6H2O
B.晶体X中不含Fe3+ , 故不可以作净水剂
C.晶体X比绿矾晶体稳定的原因是(NH4)2SO4包裹在FeSO4外部,隔绝空气对Fe2+的氧化
D.结合流程图信息,测定待测KMnO4溶液浓度时,用晶体X配标准液去滴定比绿矾误差更小
②请从溶解度角度分析冷却结晶得到晶体X而非FeSO4·7H2O或(NH4)2SO4的原因:。
反应①2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH1 K1
反应②2NO(g)=N2(g)+O2(g) ΔH2=-180.5kJ/mol K2=1×1030
反应③CO2(g)CO(g)+
O2(g) ΔH3=+283.0kJ/mol K3=2×10-46
则298K时,反应①ΔH1=kJmol;K1=;
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| T℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
T℃时,反应①的Kp=(kPa)-1。
A.使用催化剂 B.增大压强 C.增大反应物浓度 D.减小生成物浓度

反应①CO2(g)+2H2O(g)CH3OH(g)+
O2(g) ΔH1=+676.5kJ•mol-1 ΔS1=-43.9J·mol-1·K-1
反应②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=﹣50kJ•mol-1 ΔS1=-177.2J·mol-1·K-1
哪个反应更适合甲醇的工业生产,请说明理由?


已知:水与甲氧基的水解反应是甲醇生成的最后一步,解离脱附的水是与甲氧基反应生成甲醇的活性物种。下列说法正确的是____

①等压条件下,随温度升高,CO2平衡转化率先减小后增大,减小阶段以为主反应(填“反应②”或“反应③”)
②判断压强大小:p1p2(填“<”、“=”或“>”)
③保持其他条件不变,请在图3中画出p3条件下(p3<p1、p3<p2)CO2平衡转化率随温度的变化曲线。