 B .
B .  C .
C .  D .
D . 



 B .
B .  C .
C . 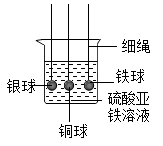 D .
D . 
选项 | 物质 | 用途 | 性质 |
A | 干冰 | 制造舞台烟雾效果 | 二氧化碳不燃烧,也不支持燃烧 |
B | 熟石灰 | 改良酸性土壤 | 熟石灰能与酸发生中和反应 |
C | 小苏打 | 治疗胃酸过多 | 小苏打能与盐酸发生反应 |
D | 稀有气体 | 制造多种用途的电光源 | 通电时可以发出不同颜色的光 |





表一物质的溶解度(20℃)
物质 | NaOH | Ca(OH)2 | CaCO3 | CaSO3 |
溶解度(克) | 109 | 0.165 | 0.0014 | 0.0043 |
表二物质溶解度等级
20℃时溶解度 (克) | >10 | 1-10 | 0.01-1 | <0.01 |
等级 | 易溶 | 可溶 | 微溶 | 难溶 |

【建立猜想】①氢氧化钡过量②盐酸过量③
【实验设计】
步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
实验方案 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 重新取样,滴加少量AgNO3溶液 | 白色沉淀 | 猜想②正确 |
Ⅱ | 重新取样,滴加足量Na2CO3溶液 | 猜想②正确 | |
白色沉淀 | 猜想③正确 |
⑴方案Ⅰ的操作和现象(填“能”或“不能”)得出“猜想②正确”这个结论;
⑵表格空白处的实验现象是:;
【表达交流】为确定猜想②是否正确,还可以选择的药品有。
A.紫色石蕊试液B.锌粒C.铁锈D.氯化钠

【提出问题】
如何测定草木灰中碳酸钾的含量?
【设计与实验】
第一步:燃烧向日葵秸秆,收集一定质量的草木灰。
第二步:用60℃水浸洗草木灰并过滤,洗涤滤渣2次,合并滤液。
第三步:蒸发滤液,烘干固体,取所得固体进行如图实验。
第四步:根据反应前后烧杯和其中溶液总质量的增加量,计算草木灰中碳酸钾的质量分数。

实验 组别 | 5%过氧化氢溶液体积/毫升 | 固体 种类 | 固体 质量/克 | 收集气体 体积/毫升 | 所需时间/秒 |
1 | 5 | — | 20 | 20 | |
2 | 5 | CuO | 0.2 | 20 | 15 |
3 | 5 | Fe2O3 | 0.2 | 20 | 12.5 |
小陈认为是氢氧化钠溶液变质产生的碳酸钠与氯化钙溶液反应,生成了碳酸钙沉淀。小越猜想:除了这种可能性外,还可能是氢氧化钠与氯化钙交换成分,生成氢氧化钙和氯化钠,由于氢氧化钙溶解度较小,从溶液中析出,产生白色沉淀。
为了检验小越的猜想,小陈设计了如下实验:
取小越实验所用的氢氧化钠溶液,加入过量的氯化钡溶液,静置后取上层液体加入氯化钙溶液,产生了白色沉淀。取该白色沉淀少许,加水后沉淀溶解,再向其中通入二氧化碳气体,观察到产生白色沉淀。

【查阅资料】①SO2能使品红溶液褪色;②SO2易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2能使氢氧化钡溶液和澄清石灰水变浑浊;④CO和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
【实验分析】
若装置按照D→A→B→D→E→F→G连接,并观察到以下现象:
装置 | D | A | B | D | E | F | G |
现象 | 变浑浊 | 褪色 | 无现象 | 变浑浊 | 变红 | 变蓝 | 变浑浊 |
由现象可以确定一定存在的气体有;
小王同学认为需要在G之后再连接一个装置H,则装置H的作用是。
方法一:火法炼铜:Cu2S+O22Cu+SO2
方法二:湿法炼铜:Fe+CuSO4=Cu+FeSO4
上述两种方法中,方法二更好的原因是除了减少空气污染之外,还有的优点。
与反应时间(t)关系如图所示。求:



请回答相关问题。
实验一:在0.365%的稀盐酸中滴入3滴酚酞,然后投入一小块大小均匀的金属钠。观察到的现象:金属钠快速反应完,并在钠球运动的轨迹上出现红色,但很快消失。实验二:在36.5%的浓盐酸中滴入3滴酚酞,然后投入一小块大小相同的金属钠。
观察到的现象:有白雾,有大量的白色小颗粒向下坠。
查阅资料:
⑴白色小颗粒(氯化钠)在稀盐酸中溶解度极小;
⑵钠和浓盐酸反应生成氯化钠:
⑶钠和水反应生成氢氧化钠和氢气。
结合上述信息并综合运用所学知识,对产生上述实验现象的原因作出解释。