①用等质量的锌粉代替锌粒
②将反应溶液适当加热
③向反应液中滴入少量溶液
④用10mL 98%硫酸代替10mL 1.0mol/L的硫酸
⑤再加入10mL 2.0mol/L盐酸
⑥向反应液中加入少量固体
|
|
|
|
表示达平衡的某反应,在 | 表示平衡 | 表示的 | 可判断某可逆反应的正反应是放热反应 |
A | B | C | D |
选项 | 实验操作 | 实验现象 | 结论 |
A | 常温下,测饱和NaA溶液和饱和NaB溶液的pH | 前者大于后者 | 常温下水解程度: |
B | 等体积、pH=3的两种酸HA和HB,分别与足量的Zn反应 | 酸HA放出的氢气多 | 酸性:HA>HB |
C | 向滴有酚酞的氨水中加入少量 | 溶液红色变浅 |
|
D | 用广泛pH试纸测定一定物质的量浓度NaClO溶液的pH | pH=9 | 次氯酸是弱酸 |
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
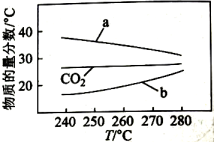
向恒压、密闭容器中通入1mol 和3mol
, 平衡时CO、
和
的物质的量分数随温度变化如图所示。下列说法不正确的是( )
实验编号 | 反应物 | 试剂组成 | 实验现象 |
① | 18mL | a | 无明显现象 |
② | 18mL | 0.4 | 一段时间出现浑浊 |
③ | 18mL | 0.4 | 出现浑浊较②慢 |
④ | 18mL | b | 出现浑浊较②快 |
⑤ | 18mL | 0.2 | 无明显现象 |
下列说法不正确的是( )
ⅰ.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2并低于100℃加热,蒸出的
用双氧水吸收,实验装置加图所示(夹持和加热装置已省略)。

ⅱ.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
ⅲ.滴加几滴酚酞作指示液,用0.01的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 | 1 | 2 | 3 | 4 |
标准液初始读数/mL | 0.00 | 0.10 | 0.30 | 0.40 |
标准液滴定终点读数/mL | 8.80 | 8.95 | 10.15 | 9.15 |
回答下列问题:
A.![]() B.
B.![]() C.
C.![]() D.
D.
a.滴定前尖嘴处无气泡,滴定后有气泡
b.盛装0.01的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时俯视刻度线,滴定终点读数时仰视刻度线
d.氮气流速过快
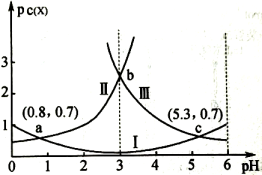
可转化为用于治疗白血病的亚砷酸(
)。亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图(a)所示。

(a)
①人体血液的pH为7.35~7.45,用药后人体中含砷元素的主要微粒是。
②将KOH溶液滴入亚砷酸溶液,当pH调至11时,所发生反应的离子方程式是
③下列说法中,正确的是(填字母序号)。
a.当时,溶液呈碱性
b.pH=12时,溶液中
c.在溶液中,

(b)
上述反应在常温下(填“能”或“不能”)自发进行。
第一步:
第二步:
写出工业上以、
为原料合成尿素的热化学方程式:。
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:

![]()
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | ||
苯乙烯(g) | 乙苯(g) | 氢气(g) | 苯乙烯(g) | |||
甲 | 1 | 3 | 0 | 0 | 1 | |
乙 | 1 | 4 | 3 | 2 | x | |
丙 | 1 | 5 | 0 | 0 | 2.5 | |
①时,向乙容器中按表格中数据投料,则此时
(填写“>”“=”“<”);
②(填写“>”“=”“<”);请解释原因。
③乙苯脱氢经历如图所示:

该环节中,温度较低时,更有利于发生的“环节”是;该催化剂在使用过程中,失活现象比较严重,由此推断“脱氢环节”除了产生 , 还会生成离开催化剂表面。
