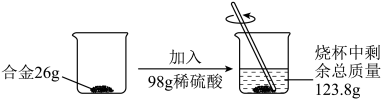
|
MnCl2 |
MnSO4 |
MnCO3 |
Mn (NO3) 2 |
Mn (OH) 2 |
|
易溶 |
易溶 |
难溶 |
易溶 |
难溶 |
锰的金属活动性介于镁和铜之间。结合以上信息和已有知识,判断下列说法正确的是____。


①如图所示,单车上标示出的部件中由金属材料制成的是(填字母序号)。
②为防止钢链条生锈可采取的措施是。
③废旧单车中金属部件回收再利用的意义是(写一点即可)。

已知:硫酸镍的化学式为NiSO4;。滤液1中的溶质为,Cu、Fe、Ni的活动性由弱到强的顺序为,固体A的成分是(写化学式)。
19世纪初,铝是比黄金还贵的金属,主要是由于铝的化学性质很活泼,在自然界中以化合物的形式存在。当时采用的与氯化铝在一定条件下发生反应得到铝,反应方程式为3Na+AlCl33NaCl+Al,因为生产成本高,所以铝十分珍贵。
19世纪末,霍尔应用电解熔融金属化合物的方法制备金属。他在用氧化铝制备金属鋁的过程中,发现氧化铝的熔点很高,很难达到熔融状态,必须物色一种能够溶解氧化铝且又能降低其熔点的材料,实验过程中他发现冰晶石(Na3AlF6)能起到这种作用。他把氧化鋁溶解在10%~15%的熔融的冰晶石里进行电解,发现有银白色小球状的铝生成,冰晶石在电解过程中不被分解,并有足够的流动性,有利于电解的进行。这种廉价炼铝方法的发现,使铝成为广泛应用的金属材料。
阅读文本,回答问题:
【查阅资料】MSO4溶液是无色液体。
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】
小影取长短、粗细相同的M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有相同体积、相同浓度的稀盐酸):
实验操作 | M丝插入试管①中 | 铜丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu;M>Al |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 |
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因是铝丝表面的氧化膜与稀盐酸反应,因而无气泡产生。

试管乙中观察到的现象是。
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序。
实验结束后,同学们对实验过程进行了如下反思:影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还与温度以及等因素有关(任写一种即可)。