
 B .
B .  C .
C .  D .
D . 
 B . 装入锌粒
B . 装入锌粒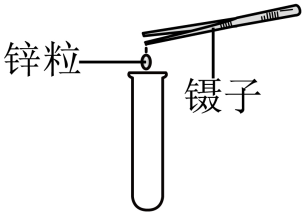 C . 制备氢气
C . 制备氢气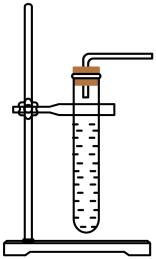 D . 收集氢气
D . 收集氢气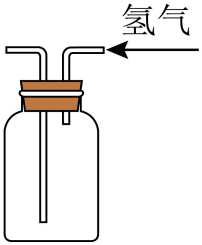


选项 | 实验目的 | 实验方案 |
A | 制备硫酸铜 | 向金属铜中加入适量的稀硫酸 |
B | 除去CaCl2溶液中的HCl | 加足量的铁粉后,过滤 |
C | 比较红磷和白磷的着火点 | 分别向浸没在冷水中的红磷和白磷通入氧气 |
D | 鉴别NH4NO3和NaOH | 分别加水溶解,测温度变化 |

①浸入液氮3分钟后,试管内产生约其容积1/3的液态空气。取出试管,液态空气沸腾,伸入燃着的木条,木条熄灭:1分钟后伸入带火星的木条,观察到木条复燃。导致燃着的木条熄灭的原因是。

②试管中能获得液态空气,是利用液氮。(填字母)
A.液氮的化学性质稳定 B.液氮温度低
利用分子筛可将氧分子从空气中“筛”出去,从而获得高浓度的氧气。其原理如图2所示,由此可知两种分子的大小:N2O2(填“<”或“>”)。
早期空间站利用过氧化钠(Na2O2)、超氧化钾(KO2)等物质与二氧化碳反应制氧,空间站内二氧化碳的主要来源是。经分析,过氧化钠吸收二氧化碳制氧的同时,还会生成一种白色固体碳酸钠,请写出碳酸钠中的阴离子符号。

①配制上述溶液,需要溶质质量分数为30%的过氧化氢溶液(密度为1.11 g/mL)的体积为mL(计算结果精确至0.1 mL)。
②用量筒量取所需液体,当液面接近指定刻度时,需改用(填仪器名称)添加液体。
③配制上述溶液需用量筒量取80.0 mL水,若最终加水停止时液面如图1所示,则所配溶液中溶质质量分数(填“>”、“<”或“=”)6%。
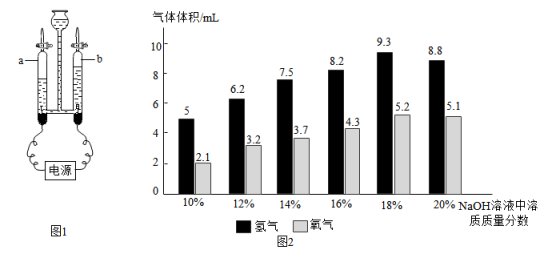
①仪器a的名称是。写出锥形瓶中发生反应的化学方程式。若锥形瓶中反应速率过快,在其他仪器、装置都不变的情况下,可采取的措施是。(答一点即可)
②图2装置也可以用于实验室制备CO2 , 其化学反应方程式为。
①白磷(化学式为P4)燃烧的化学反应方程式为。
②实验中,发现白磷a燃烧而白磷b未燃烧,说明燃烧的条件之一是。
2023年6月1日,我国首个海上CO2封存项目成功投入使用。原理是将油井开采产生的油气混合物注入高碳分离器,再将分离出的CO2通入压缩机加压和干燥,使其变成介于气态和液态之间的超临界状态。
从微观角度分析,二氧化碳容易被压缩的原因是。

资料:①吸收池中盛有饱和K2CO3溶液,发生反应K2CO3+H2O+CO2=2KHCO3;
②碳酸氢钾加热至100~120℃则分解,200℃时完全分解,失去二氧化碳和水而成碳酸钾。
分解池中的温度须控制在200℃以上,原因是。

某小组采用图1所示实验装置探究CO还原Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是Fe;乙同学提出质疑,认为黑色固体可能是Fe3O4。
资料:①铁的氧化物与稀的酸溶液反应时,均无气泡产生;
②Fe、FeO和Fe3O4均为黑色固体,Fe和Fe3O4可被磁铁吸引,而FeO和Fe2O3不能被磁铁吸引。
图1 图2
图2 
制备CO的原理是:HCOOHCO↑+H2O(HCOOH在常温下为液态),图2所示三种气体发生装置中,可用于制备CO的是(填装置标号)。
①定量分析物质组成可知,该反应生成Fe3O4是合理的,理由是。
②实验结束后,该小组同学通过实验的方法证明了产物中含有铁,请写出检验的操作和现象是:取样于试管中,。

①用CO炼铁时,还原Fe2O3的温度应不低于℃。(填“400”“600”或“800”)
②图中:x=。