 B . 潮州小吃红桃棵
B . 潮州小吃红桃棵 C . 潮州大鼓
C . 潮州大鼓 D . 潮州瓷器
D . 潮州瓷器
选项 | 劳动项目 | 化学知识 |
A | 食用盐中加碘酸钾 | 补充碘元素,预防甲状腺机能亢进 |
B | 将小苏打加入面粉中焙制糕点 | 小苏打属于酸式盐,可以与碱反应 |
C | 使用复合肥料培育植物 | 复合肥含N、P、K三种元素中的两种或三种 |
D | 盐碱地(含较多Na2CO3等)施用适量石膏,降低土壤的碱性 | 盐与盐发生复分解反应 |
 B . HClO的电子式为
B . HClO的电子式为 D . 基态氧原子的电子排布图为
D . 基态氧原子的电子排布图为

|
|
|
|
A.测定锥形瓶中污水样品中c(OH-) | B.制备O2 | C.验证牺牲阳极法保护铁 | D.关闭a,打开b,可检查装置的气密性 |
选项 | 实验操作和现象 | 实验结论 |
A | 向1mL1mol/LNaCl溶液中滴加2滴1mol/LAgNO3溶液,生成白色沉淀;再滴加2滴1mol/LKI溶液,白色沉淀变成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
B | 室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解有无色无味气体产生 | Ksp(BaSO4)>Ksp(BaCO3) |
C | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH大 | 非金属性:S>C |
D | 乙酸乙酯的制备实验中,将产生的蒸气经导管通入到饱和NaOH溶液中,振荡,溶液未见分层 | 实验中未制备乙酸乙酯 |
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SiO2为共价晶体,Si-O键能大 | SiO2熔沸点高,不能与强碱反应 |
B | Na2FeO4具有强氧化性且Fe3+可水解产生胶体 | Na2FeO4可做消毒剂和净水剂 |
C | N的电负性较大 | N2较稳定,常温下不易发生反应 |
D | 硅酸钠溶液水解呈酸性,形成硅酸沉淀 | 硅酸钠溶液可用于木材防腐 |



①实验开始前,装置A中盛放浓盐酸的仪器名称是。写出A装置中发生反应的离子方程式。
②在答题卡上将F装置补充完整,并标注相应试剂名称。
CH3COOC2H5+NaOH→CH3COONa+C2H5OH
实验试剂:0.010mol/LNaOH溶液、0.010mol/L乙酸乙酯、蒸馏水
方案1:查阅资料可知水解溶液电导率随c(OH-)降低而减小,温度对该反应电导率影响可以忽略不计。通过测定不同时刻的电导率,来探究乙酸乙酯水解速率的影响因素,设计如下实验。
实验步骤:向试管中加入10mL0.010mol/LNaOH溶液,再加入10mL0.010mol/L乙酸乙酯,再把试管放入置于30℃恒温槽中,每隔10min用电导率仪测定电导率,重复3次,电导率取平均值,改变温度至35℃,重复实验3次,电导率取平均值。
数据记录:乙酸乙酯水解后电导率(单位为mS/cm)
组别 | 温度 | 时间/min | |||||
0 | 10 | 20 | 30 | 40 | 50 | ||
1 | 30 | 1417 | 1173 | 1056 | 976 | 907 | 869 |
2 | 35 | A1 | A2 | A3 | A4 | A5 | A6 |
①分析第1组实验中数据,随着反应进行,反应速率(增大、减小、不变),从速率影响因素角度分析其原因是。
②从上述实验中能得出温度升高,反应速率增大判断依据是(用字母和数字表示)。
方案2:利用乙醇测定仪直接测定反应相同时间(t)后溶液中乙醇的浓度来探究乙酸乙酯碱性环境水解速率的影响因素(NaOH溶液浓度、反应温度),设计如下实验。
③参照下表格式,在已有基础上拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 实验序号 | 0.010mol/L乙酸乙酯溶液体积/mL | ________ | ________ | ________ | 反应相同时间后乙醇浓度/mol/L |
| 1 | 10 | ________ | ________ | ________ | c1 |
| 2 | 10 | ________ | ________ | ________ | c2 |
| 3 | 10 | ________ | ________ | ________ | c3 |

回答下列问题:

①其中B表示(填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为g/cm3(列算式用NA表示阿伏加德罗常数的值)。
主反应反应Ⅰ:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H1>0
副反应反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
化学键 | H-H | C≡O | O-H | C=O |
键能/(kJ/mol) | a | b | c | d |


序号 | 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
a | 还原反应 | ||
b | 酯化反应 |
 为含碳原料,利用题干信息,合成化合物
为含碳原料,利用题干信息,合成化合物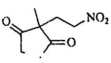 , 基于你设计的合成路线,回答下列问题:
, 基于你设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为(写结构简式)。
(b)相关步骤涉及到![]() 消去反应,其化学方程式为。
消去反应,其化学方程式为。