选项 | 实验目的 | 实验操作(方案) |
A | 除去铜粉中少量的Fe | 加足量的稀盐酸,过滤、洗涤、干燥 |
B | 鉴别二氧化碳和氮气两瓶气体 | 将燃着的木条分别伸入集气瓶中 |
C | 检验硬水和软水 | 取样,滴加肥皂水,振荡,观察现象 |
D | 区分化肥 | 取样,加少量熟石灰粉末,混合研磨,闻气味 |
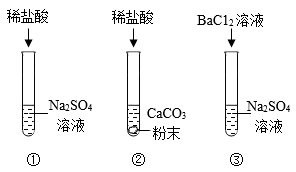
试管内物质 | 滴管内物质 | |
A | 氢氧化钠固体 | 水 |
B | 二氧化碳气体 | 氢氧化钠溶液 |
C | 氯化钡溶液 | 稀硫酸 |
D | 铁片 | 稀盐酸 |
A | B | C | D |
|
|
|
|
探究温度对分子运动快慢的影响 | 探究氧气含量对反应剧烈程度的影响 | 探究空气与呼出气体中二氧化碳的含量 | 探究反应物浓度对反应速率的影响 |
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 研究二氧化锰的催化作用 | 证明二氧化碳能与水反应 | 区分硬水和软水 | 测定空气中氧气的含量 |
| 选项 | 实验目的 | 实验方案 |
| A | 区分CO和CH4 | 点燃,观察火焰的颜色 |
| B | 比较Zn、Cu、Ag的金属活动性强弱 | 将Zn和Cu分别放入硫酸铜溶液中 |
| C | 鉴别K2CO3、KCl、HCl、Ba(NO3)2四种溶液 | 相互反应即可鉴别 |
| D | 分离CaCl2和CaCO3固体混合物 | 加水,溶解,过滤 |
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO2中含有的少量CO | 点燃 |
| B | 鉴别红磷与白磷 | 观察颜色 |
| C | 鉴别氧化铜和铁粉 | 用磁铁吸引 |
| D | 除去氧化铜中少量的木炭粉 | 空气中灼烧 |
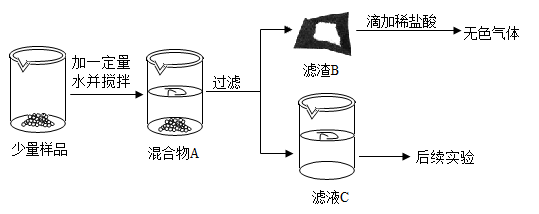
①取少量固体粉末于试管中,加足量的水溶解,静置后得到白色沉淀A和无色溶液B;
②过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解;
③取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到溶液C;
④在溶液C中滴加硝酸银溶液,有白色沉淀产生。
以下说法正确的是( )
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaCl 猜想二:NaCl、Na2SO4猜想三:。
实验操作 | 实验现象 | 结论 |
步骤一:取少量滤液于试管中,加入适量BaCl2溶液 | 无明显现象 | 猜想不成立 |
步骤二:取少量滤液于试管中,加入适量稀硫酸 | 有白色沉淀生成 | 猜想三成立 |
I、探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ、依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用(填字母序号)也能达到同样的实验目的。
a.稀盐酸 b.氢氧化钠溶液 c.碳酸钠溶液
【查阅资料】①Ca(OH)2、Na2CO3溶于水无温度变化。
②CaCl2溶液呈中性。
甲的猜想:Na2CO3
乙的猜想:NaOH
丙的猜想:NaOH和Na2CO3
丁的猜想:NaOH和Ca(OH)2
【设计方案并进行实验】针对猜想,甲、乙、丙分别设计方案并探究如下:
甲:取滤液C于试管中,滴加足量稀盐酸,有气泡产生,则滤液C中的溶质是Na2CO3
乙:取滤液C于试管中,滴加酚酞溶液,酚酞溶液变红色,则滤液C中的溶质一定含有NaOH
丙:取滤液C于试管中,滴加Ca(OH)2溶液,有白色沉淀产生,向上层清液中滴加无色酚酞溶液,溶液变成红色,则滤液C中的溶质是NaOH和Na2CO3
【反思与评价】丁通过甲的实验现象,否定了自己的猜想,其理由。丁认真分析上述三位同学的实验,认为他们通过实验获得的结论均有不足之处:甲的结论不正确的原因。乙的结论不正确的原因。经过大家讨论,一致认为丙的实验只要把Ca(OH)2溶液换成(填试剂及用量),就能得出正确的结论。有关反应的化学方程式。
同学们还发现:向样品中加入一定量的水并搅拌,会观察到放热。综合对滤液和滤渣成分的探究,下列对样品的分析正确的是(填序号)。
①一定含NaOH ②一定含Na2CO3
③一定含有CaCO3④一定含NaOH、CaO中的一种或两种
猜想三:产物中含有。
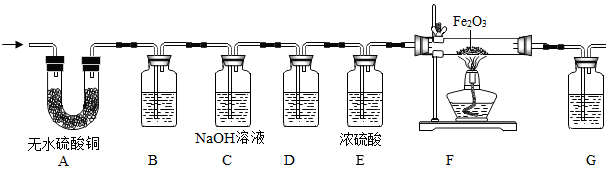
实验前,待,再点燃装置F中的酒精灯对固体进行加热。
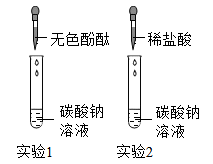
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl;
猜想二:废液中的溶质可能是NaCl、Na2CO3;
猜想三:废液中的溶质可能是。
方案一:
|
实验操作与现象 |
化学方程式 |
实验结论 |
|
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 |
|
猜想二正确 |
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。
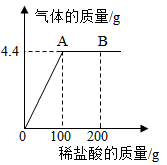
①产生CO2的质量为g。
②滴入稀盐酸至恰好完全反应时,所得溶液中溶质的质量分数是多少?