醋酸溶液能导电 |
氧炔焰切割金属 |
五彩缤纷的烟花 |
铸钢模具须提前干燥 |
A.与盐类水解有关 | B.与乙炔和氧气反应放热有关 | C.与核外电子的跃迁有关 | D.与铁与水能发生反应有关 |
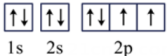
图1 不同融雪剂融冰量比较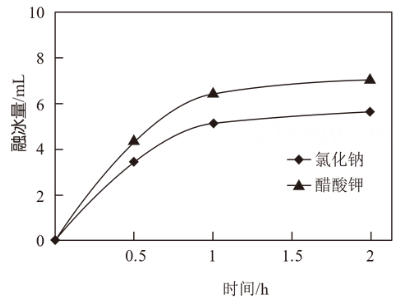 图2 不同盐溶液对碳钢腐蚀比较
图2 不同盐溶液对碳钢腐蚀比较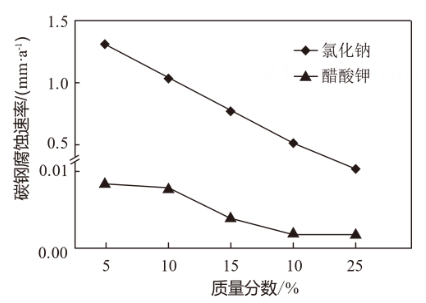
实验 | 起始时各物质的浓度/(mol·L-1 ) | 平衡时物质的浓度/(mol·L-1 ) | ||
c(H2) | c(I2) | c(HI) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0.008 |
Ⅱ | 0.02 | 0.02 | 0 | a |
Ⅲ | 0.02 | 0.02 | 0.04 | |
实验装置 | 编号 | 锥形瓶中的 试剂 | 实验现象 | 锥形瓶内CO2的浓度变化 |
 | ① | 6.0 g 1 mol·L−1 NaHCO3溶液 | 有极微量气泡生成,15 min后测得溶液的pH无明显变化 |  |
② | 6.0 g 1 mol·L−1 NaHCO3溶液和0.1g镁条 | 持续产生大量气泡(净化后可点燃),溶液中有白色浑浊生成。15 min后测得溶液的pH上升至9.0 | ||
③ | 6.0 g H2O(滴有酚酞溶液)和0.1 g镁条 | 镁条表面有微量气泡,一段时间后,镁条表面微红 |
下列说法不正确的是( )
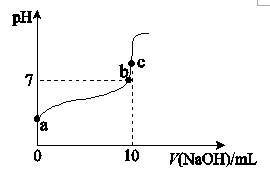
①c(Na+) =c(CH3COO−)的点是.(填“a”、“b”或“c”,下同)。
②水的电离程度最大的点是 。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①CH3COOH的电离平衡常数表达式Ka=。
②比较等物质的量浓度溶液的pH:pH(NaClO) pH(CH3COONa) (填“>”、“<”或“=”)。
③预测下列化学反应能够发生的是。
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2
MgH2与H2O反应制备H2的化学方程式是。
物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
Ksp | 5.6×10−12 | 5.5×10−16 | 2.2×10−20 |
①MgH2与H2O反应时,最初生成H2的速率很快,但随后变得缓慢,原因是。
②在水中加入优先与OH-结合的离子,能够避免①中现象发生,提升H2的制备效率。下列物质中,能达到此目的的是。
a.NaNO3 b.NiCl2 c.CuCl2

① a极为(填“正”或“负”)极。
② 甲装置中,Na+向极移动(填“a”或“b”)
③下列关于乙装置说法中,正确的是。
A.在c极区获得氯气
B.在d极区获得的产物,可供甲装置使用
C.当NaCl溶液浓度较低时,及时更换为精制饱和NaCl溶液,以保证生产效率

已知:i.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
ii.部分物质的溶度积常数如下(25℃)
物质 | Ksp |
CaF2 | 4.0×10−11 |
Fe(OH)3 | 2.8×10−39 |
iii.CoSO4•7H2O溶解度随温度升高而明显增大
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2+ + [Fe(CN)6]3− = Co3+ + [Fe(CN)6]4−。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取m g硫酸钴晶体,加水配成200 mL溶液,取20 mL待测液进行滴定,消耗V1 mL铁氰化钾标准液、V2 mL Co(Ⅱ)标准液。(Co的相对原子质量为59)
计算样品中钴含量ω=(以钴的质量分数ω计)。
反应 Ⅰ 3Cu + 2NO + 8H+ = 3Cu2+ + 2NO↑ + 4H2O
反应 Ⅱ 。
①设计实验:取3 g 铜粉加入到100 mL 溶液中,振荡、静置30分钟。
②若反应 Ⅰ能够发生,预计观察到的现象有。
实际现象不明显,借助传感器证明反应Ⅰ能够发生。
步骤1:取3 g 铜粉加入到100 mL 0.3 mol/L Fe2(SO4)3溶液(用H2SO4调pH=1)中,溶液迅速变为蓝绿色。
步骤2:取步骤1中上层清液,滴加少量KSCN溶液,出现白色浑浊,溶液变红,振荡后红色褪去。
①KSCN溶液的作用是 。
②已知,CuSCN是难溶于水的白色固体。结合平衡移动原理,解释步骤2中“溶液变红,振荡后红色褪去”的原因。