 读取液体体积
B .
读取液体体积
B . 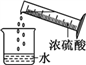 稀释浓硫酸
C .
稀释浓硫酸
C .  制取氢气
D .
制取氢气
D . ①用石灰石处理实验室的废盐酸 ②用碳酸水改良碱性土壤 ③用熟石灰和硫酸铜配制波尔多液 ④用氢氧化钠溶液处理泄漏的浓硫酸
物质 | 柠檬 | 苹果 | 牛奶 | 玉米粥 |
pH | 2.1~2.8 | 2.6~3.7 | 6.3~6.6 | 7.1~8.0 |

|
选项 |
A |
B |
C |
D |
|
实验操作 |
|
|
|
|
|
实验现象 |
烧杯中溶液的pH值减小 |
甲中木条无明显变化,乙中木条熄灭 |
气球变鼓 |
天平指针不发生偏转 |
|
实验结论 |
氢氧化钠和盐酸发生了中和反应 |
呼出气体中二氧化碳含量更高 |
氢氧化钠能与二氧化碳发生反应 |
化学反应遵守质量守恒定律 |


方案 | 实验目的 | 实验方法 |
A | 鉴别NaOH固体和NH4NO3固体 | 加水溶解,比较温度 |
B | 鉴别稀盐酸和稀硫酸 | 分别加入BaCl2溶液,观察现象 |
C | 除去CO2中的HCl | 通入NaOH溶液中 |
D | 除去FeCl2溶液中CuCl2 | 加入过量的铁粉,过滤 |
 向一定质量二氧化锰固体中加一定质量过氧化氢溶液
B .
向一定质量二氧化锰固体中加一定质量过氧化氢溶液
B .  少量氧化钙放入过量饱和石灰水中并恢复至原温
C .
少量氧化钙放入过量饱和石灰水中并恢复至原温
C .  向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
D .
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
D .  向一定量的稀盐酸中加入氢氧化钠溶液
向一定量的稀盐酸中加入氢氧化钠溶液

①为确定步骤2中碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量(填溶液名称),若观察到试管内有气泡产生,则分解不完全。
②上述设想的优点有(填序号)。
a.原料易得且可循环使用 b.充分利用太阳能 c.可全地域全天候使用

A两溶液中溶质的质量分数相等
B分别升温至t2℃,所得溶液中溶质的质量分数相等(不考虑水的挥发)
C保持t1℃不变,分别加入等质量的水,所得溶液中溶质的质量分数相等


|
|
|
实验一:电解水实验 | 实验二:气体制备 | 实验三:粗盐提纯 |
①精盐的产率为。
②上述粗盐提纯实验中,若精盐产率偏大可能的原因是(填字母)。
A.溶解时量取水仰视读数
B.过滤时滤纸破损
C.蒸发结晶时水分未蒸干
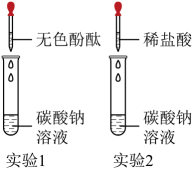
已知:硫酸钠溶液呈中性
【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl;
猜想二:废液中的溶质可能是NaCl、Na2CO3;
猜想三:废液中的溶质可能是。
方案一:
实验操作与现象 | 化学方程式 | 实验结论 |
小芳取少量废液于试管中,滴加澄清石灰水,有白色沉淀产生 | 猜想二正确 |