①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)⇌2C(g)+D(s),已知将2molA和1molB
充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n%。
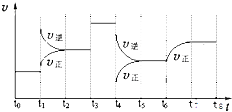
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图),则该反应的正反应是 反应。
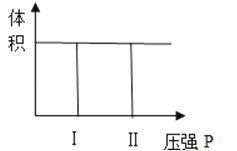
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L.
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n>10a;
试解释形成第②种结果的可能原因是
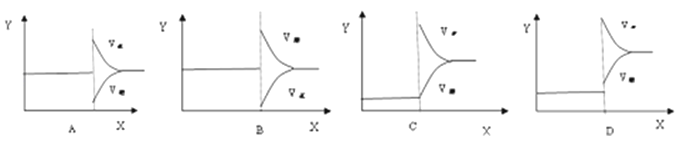
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为
(4)若维持该题原条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol.则D的起始物质的量n(D) 应满足的条件是 (用含有W的代数式表示)
一定条件下反应A(g)+B(g)⇌C(g)△H<0达到平衡后,据下列图象判断:
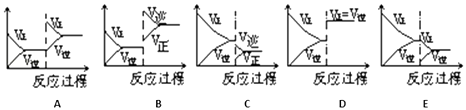
达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
(i)使用催化剂 | ||
(ii)升温 | ||
(iii)降压 | ||
(iv)增加A的量 | ||
(v)减少C的量 |
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 500 | 8 | 4 | 3.2 | 4 |
2 | 700 | 4 | 2 | 0.8 | 3 |
3 | 700 | 4 | 2 | 0.8 | 1 |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
②实验2中,反应达到平衡状态时,CO的转化率为.
③实验3和实验2相比,改变的条件是.
②欲使0.1mol的Na2S溶液中, 的值增大,可采取的措施是(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
反应达到平衡后,只增加B的物质的量,则平衡移动方向为;平衡常数K(填增大.减小或不变).
反应②Fe(s)+H2O(g)⇌FeO(s)+H2(g);△H=Q2 , 平衡常数为K2 ,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
根据反应①与②推导出K1、K2、K3的关系式K3=,Q1、Q2、Q3的关系式Q3=,可推断反应③是(填“放”或“吸”)热反应.
图甲中t2时刻改变的条件可能是,图乙中t2时刻改变的条件可能是.

试回答下列问题: