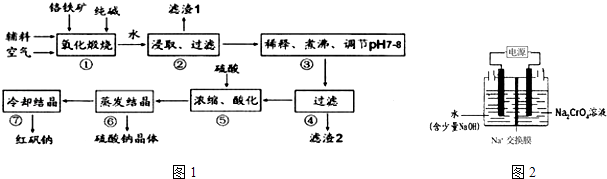
步骤①中主要反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
①酸化后所得溶液中 c(Cr2O72﹣ )=
②工业上也可设计图2示装置(两极均为惰性电极)电解Na2CrO4溶液制取 Na2Cr2O7 , 图2中右侧电极的电极反应式为.若电解前两侧溶液的质量相等,则当电解过程中转移了1mol 电子时两侧溶液的质量差为g.
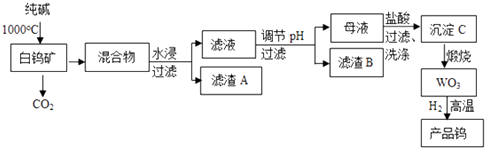
已知:
①钨酸酸性很弱,难溶于水
②完全沉淀离子的pH值: 为8,
为5
③碳和金属钨在高温下会反应生成碳化钨
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液

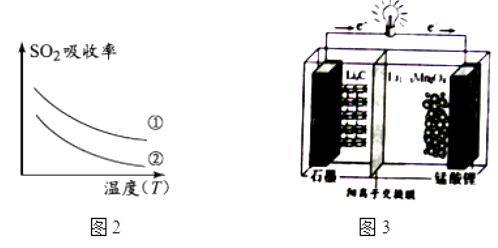
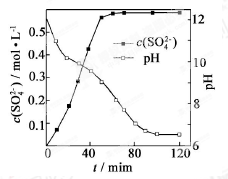
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
实验序号 | SO2浓度(g•m﹣3) | 烟气流速(mL•min﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.

回答下列问题:

请回答下列问题:
①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是.
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为,当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.

阳极的电极反应式为,阴极产生的物质A的化学式为.
七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图:

已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
以磷石膏(只要成分CaSO4 , 杂质SiO2、Al2O3等)为原料可制备轻质CaCO3

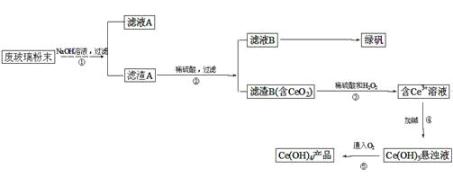
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下:
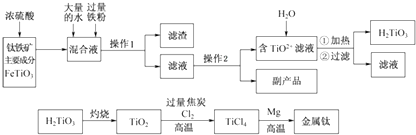
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4 , TiOSO4遇水会水解.
请回答下列问题:
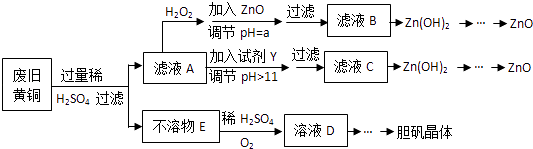
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算).
|
|
Fe3+ |
Fe2+ |
Zn2+ |
|
开始沉淀的pH |
1.1 |
5.8 |
5.9 |
|
沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是.