 C .
C . ①将金属Na投入水中:2Na+2H2O=2Na++2OH﹣+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO3﹣+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO32﹣+2H+=CO2↑+H2O.

①恒容时发生反应:A(g)+B(g)⇌3C(g)
②恒压时发生反应:A(g)+B(g)⇌2C(g)
③恒容时发生反应:A(g)+2B(g)⇌2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)⇌3C(g)J﹣D(s)
化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
甲烷 | 891.0 | 正丁烷 | 2 878.0 |
乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
下列表达正确的是( )

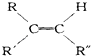
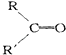 +
+ 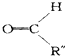 .
.
已知:
①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或氢氧化钠溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与氢氧化钠溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2).
请根据上述信息,完成下列填空:
A,C,E.
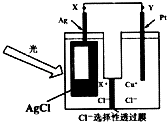
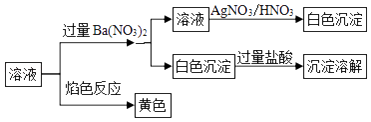
某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:
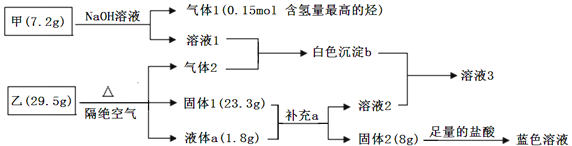
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解.请回答下列问题:
①对试管内的绿色固体进行加热至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀盐酸,观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
请回答下列问题:


常温条件下的有关数据如表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm﹣3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
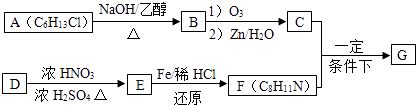
已知以下信息:
① 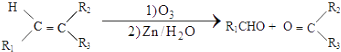
②1molB经上述反应可生成2molC,且C不能发生银镜反应.
③D属于单取代芳香烃,其相对分子质量为106.
④核磁共振氢谱显示F苯环上有两种化学环境的氢.
⑤RNH2+ 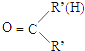
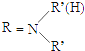
回答下列问题:
![]()
H
I
J
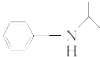
反应条件1所选择的试剂为;反应条件2所选择的试剂为_;I的结构简式为.
ⅠCO(g)+2H2(g)⇌CH3OH(g)△H1
ⅡCO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=﹣58kJ/mol
ⅢCO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
已知四种物质的标准生成热如表:
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | ﹣110.52 | ﹣393.51 | 0 | ﹣201.25 |
A.计算△H1=kJ/mol B.△H30(填=、<、>)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
下列说法正确的是
①α(CO)值随温度升高而(填“增大”或“减小”),其原因是.
②图中P1、P2、P3的大小关系为,其判断理由是.
