 B . 厨余垃圾
B . 厨余垃圾 C . 有害垃圾
C . 有害垃圾 D . 其他垃圾
D . 其他垃圾
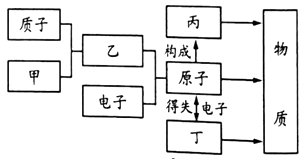
1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子 是电中性的,由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家的不断完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成网络图,则汤姆生当年推测的“带正电的物质”相当于图中的( )
查阅资料发现,古代低等生物遗骸大量沉积,经过漫长的地质年代形成石油及天然气,海底的天然气与水在高压低温条件下形成的类冰状的固体物质即“可燃冰”。“可燃冰”为甲烷的水合物,遇火即可燃烧且热值高,是一种环保、高效的新能源。
材料一:可燃冰,学名天然气水化合物,其化学式为CH4•8H2O,它是天然气的固体状态(因海底高压埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气)。其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成“可燃冰”。
材料二:“蓝鲸一号”钻探平台设计和建造过程刷新了多项世界记录。它长117米,宽92.7米,高118米,质量为42000吨。
请根据上述材料回答:
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的。这些细菌分解有机质(选填“需要”或“不需要”)氧气。这些细菌与真菌在细胞结构上的主要区别是。
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有的能力。
①可燃冰(CH4•8H2O)中C:H:O的元素质量比是。甲烷属于(选填“有机物”或“无机物”)。
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条)。(可燃冰在空气中燃烧的化学方程式为CH4•8H2O+2O2 CO2+10H2O)
我省开展“全面剿灭劣V类水”行动。为了治理某河道的水污染,相关部门放置一批太阳能仿生水草,几个月后效果明显。太阳能仿生水草主要由太阳能电池板、小型送风电动机以及若干人造水草等构成(如图)。太阳能电池板为电动机供电,电动机工作,给河水持续提供空气,增加水体中的溶解氧。

