

选项 | 实验操作 | 现象 | 结论 |
A | 某溶液中滴加足量盐酸酸化的 BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有SO42﹣ |
B | 将Cl2通入石蕊试液中 | 石蕊试液先变红 后褪色 | Cl2具有漂白性 |
C | 用洁净的铂丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 原溶液一定含有Na+ , 一定不含K+ 有 |
D | 将KI和FeCl3溶液在试管中混 合后,加入CCl4 , 振荡,静置 | 下层溶液显紫红 色 | 氧化性Fe3+>I2 |
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
a.需用到的药品除1mol•L﹣1CuSO4溶液、稀硫酸外还需(填试剂的化学式)溶液.
b.用胆矾晶体配制1mol•L﹣1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、
玻璃棒、胶头滴管外,还有(填仪器名称).
c.为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②.
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
a.写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:.
b.从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜(填稳定或不稳定),
溶液中正一价铜比正二价铜(填稳定或不稳定).
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g气体Y.
a.仪器A的名称是.
b.X的化学式为.
资源的高效利用对保护环境.促进经济持续健康发展具有重要作用.磷尾矿主要含Ca5(PO4)3F和CaCO3•MgCO3 . 某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2其简化流程如图:
已知:①Ca5(PO4)3F在950℃不分解
②4Ca5(PO4)3F+18SiO2+30C ![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=﹣937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
(1)已知:①CH4(g)+2O2 =CO2(g)+2H2O(g)△H=﹣890.3 kJ•mol﹣1
②CO(g)+H2O(g)=H2(g)+CO2(g)△H+2.8 kJ•mol﹣1
③2CO(g)+O2(g)=2CO2(g)△H=﹣566.0 kJ•mol﹣1
则反应CH4(g)+CO2(g)⇌2CO+2H2(g)△H=
(2)天然气的一个重要用途是制取H2 , 其原理为:CH4(g)+CO2(g)⇌2CO(g)+2H2(g).一定条件下,在密闭容器中,通入物质的量浓度均为0.1mol•L﹣1的CH4与CO2 , 在发生反应,测得CH4的平衡转化率与温度及压强的关系如图l所示,

①该反应的平衡常数表达式为
②则压强p1 P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于“、“小于”或“等于“).
(3)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 .
(4)工业上又常将从天然气分离出的H2S,在高温下分解生成硫蒸气和H2 , 若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,H2S在高温下分解反应的化学方程式为
(5)科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4 .
①写出铜电极表面的电极反应式 .
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”).
石墨烯的球棍模型及分子结构示意图如图1:
(1)下列有关石墨烯说法正确的是
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合.
①钴原子在基态时,核外电子排布式为: .
②乙醇沸点比氯乙烷高,主要原因是 .
③图2是金与铜形成的金属互化物合金,它的化学式可表示为:
④含碳源中属于非极性分子的是 (a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如图3,酞菁分子中氮原子采用的杂化方式有 :酞菁铜分子中心离子的配位数为: .

莫沙朵林(F)是一种镇痛药,它的合成路线如下:

已知:①
②Diels﹣Alder反应: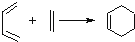
③
回答下列问题
(1)下列有关莫沙朵林(F)的说法正确的是 .
A.可以发生水解反应
B.不能发生加聚反应
C.1mol莫沙朵林最多可以与3mol NaOH溶液反应
D.不可与盐酸反应
(2)B中手性碳原子数为 ;
(3)C与新制氢氧化铜反应的化学方程式为 .
(4)已知E+X→F为加成反应,化合物X的结构简式为 .
(5)写出同时满足下列条件的E的一种同分异构体的结构简式为 .
①1H﹣NMR谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应.
(6)以 和
和 为原料合成
为原料合成 , 请设计合成路线(注明反应条件) .
, 请设计合成路线(注明反应条件) .
注:合成路线流程图示例如下: