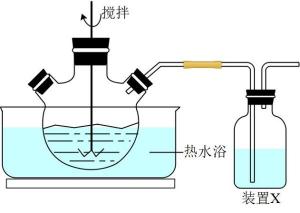
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
开始沉淀pH | 7.6 | 1.5 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 9.8 |
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。