

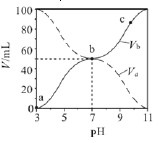
已知:常温下, ,pOH=-lgc(OH-)。
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO
+Ba(IO3)2=BaWO4+2IO
;交换结束后,向所得含IO
的溶液中加入适量酸化的KI溶液,发生反应:IO
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
=2I-+S4O
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。
![]() +KMnO4→
+KMnO4→  + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl
|
名称 |
相对分 子质量 |
熔点/℃ |
沸点/℃ |
密度/(g·mL−1) |
溶解性 |
|
甲苯 |
92 |
−95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
—— |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
A.70% B.60% C.50% D.40%
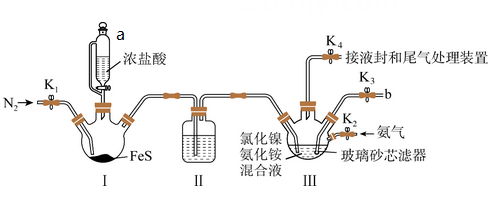
称取试样(杂质中不含Ni) mg置于锥形瓶中,用稀酸溶解后加入掩蔽剂掩蔽其他离子,加pH≈10的氨性缓冲溶液5mL紫脲酸铵指示剂少许。用0.0200mol/L EDTA (Na2H2Y)标准溶液滴定,发生反应: Ni2++H2Y2- NiY2-+ 2H+。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为。
②滴定过程中,若氨性缓冲溶液pH值过低,导致测得的产品纯度 (填“偏低”、 “偏高”或“不影响”)。

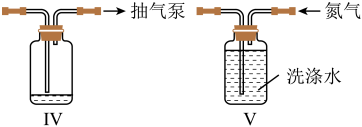
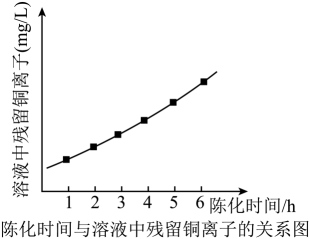
设计由100mL“滤液”[其中c(Fe3+)=0.8mol•L-1]制备硫酸亚铁粗品的实验方案:。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
Ⅰ.NH4ReO4的纯度测定
称取w g NH4ReO4样品,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L-1的盐酸标准溶液吸收,蒸氨结束后取下接收瓶。取吸收液用c2mol·L-1NaOH标准溶液滴定过剩的HCl, 达到终点时消耗V2mLNaOH溶液。

部分指示剂变色的pH范围如下表:
| 指示剂名称 | 变色的pH范围 | 酸色. | 中性色 | 碱色 |
| 甲基橙 | 3.1--4.4 | 红 | 橙 | 黄 |
| 甲基红 | 4.4一6. 2 | 红 | 橙 | 黄 |
| 溴百里酚蓝 | 6.0-7.6 | 黄 | 绿 | 蓝 |
| 酚酞 | 8.2-10.0 | 无 | 浅红 | 红 |
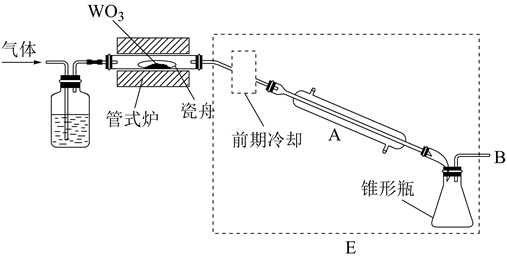
高温下用H2还原NH4ReO4可制得金属铼,装置如下图所示:
[已知:NH4ReO4 受热分解生成Re2O7]
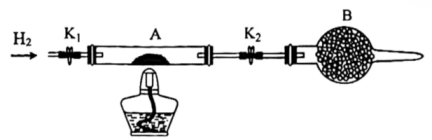
② 装置B中盛放的试剂为(填名称)。
②判断A中NH4ReO4已经反应完全的方法是。
③玻璃管内发生反应的化学方程式为。
![]()
索氏提取装置如图所示.实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置a,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:


a.加水溶解、蒸发浓缩、冷却结晶
b.加70%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
 )中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取样品
)中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取样品①滴定终点的现象为;
②三次滴定数据记录如下:
滴定次数 | 待测液体( | 标准液读数( | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 1.50 | 41.52 |
第二次 | 25.00 | 3.00 | 42.98 |
第三次 | 25.00 | 4.50 | 41.60 |
青蒿素的纯度为。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
①打开开关A、C,放入酸溶液产生CO2 , 目的是;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是。
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。
化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。
实验序号 | 实验操作 | 实验现象 |
1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
经检验反应产生的气体有H2 , 实验室检验H2的方法为。
|
实验序号 |
实验操作 |
|
2 |
分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
|
3 |
分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |
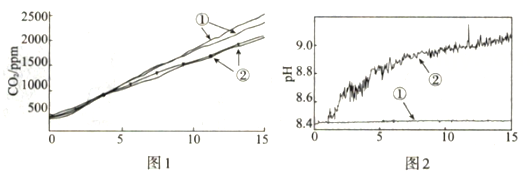
图1中曲线②对应的CO2含量逐渐增大的原因为 (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为。
小组成员推测可能是溶液中的Na+或HCO加快了该反应的发生,对比实验1设计实验如下:
|
实验序号 |
实验操作 |
实验现象 |
|
4 |
向 溶液中加入长3 cm的镁条 |
持续快速产生大量气泡,溶液略显浑浊 |
①实验4中横线处内容为。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO能加快该反应的原因为。
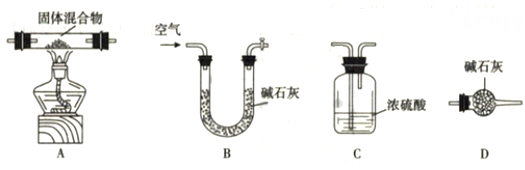
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为(填字母编号)。
①制取过-硫酸(H2SO5) :先在三颈烧瓶中加入吸附型双氧水稳定剂,然后加入冷的双氧水和过量的浓硫酸,pH控制在2. 0~2.5,反应30 min(反应装置如图所示);
②过-硫酸氢钾复合盐的制备:向①中反应后的溶液中加入碳酸钾溶液,边加边搅拌,碳酸钾溶液滴加完毕后,反应30min,将反应后的混合液转移至烧杯中,在-10℃条件下冷却结晶后,将混合液转移到抽滤瓶中抽滤,得到滤饼,将滤饼置于电热鼓风干燥箱中烘干,得到产品过-硫酸氢钾复合盐。

回答下列问题:
检测原理:2KHSO5 =K2SO4+H2SO4+O2↑
4I-+4H+ +O2=2I2+2H2O
I2+2S2O=S4O
+2I-
量取75 mL蒸馏水于碘量瓶中,加入适量的稀硫酸和过量的碘化钾溶液,称取a g产品于碘量瓶中摇匀。暗处放置5 min后,用c mol·L-1的标准硫代硫酸钠溶液滴定,终点时消耗的体积为V mL,则样品中活性氧的质量分数是。

已知:Cl2与NaOH溶液在加热的条件下反应生成NaClO3和NaCl;
回答下列问题:
①装置C如果采用热水浴会使“消洗灵”(Na10 P3O13 Cl·5H2O)的产率(填“升高”或“降低”)。
②“系列操作”包括、、过滤、洗涤、低温干燥。
Ⅰ.取1.500g产品试样溶于蒸馏水中配成100mL溶液;
Ⅱ.量取25.00mL待测液于锥形瓶中,加入 10mL2mol·L−1硫酸溶液、25mL0.1mol·L−1KI溶液(过量),暗处静置5min;
Ⅲ.滴加2~3滴淀粉溶液,用 0.05mol·L−1Na2S2O3标准溶液滴定,发生反应:。平行滴定三次,平均消耗20.00mL标准溶液,则产品的纯度为(保留三位有效数字)。Na2S2O3标准液应放在(填“碱”或“酸”)式滴定管中。
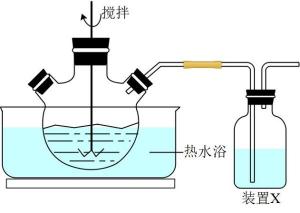
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
开始沉淀pH | 7.6 | 1.5 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 9.8 |
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
①已知含铬酸性废水中存在着Cr2O和CrO
相互转化的平衡,请用离子方程式表示它们之间的转化反应。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为。(写化学式)。
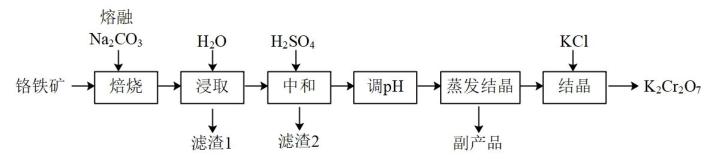
①氧化还原滴定过程中的离子方程式为。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为%。[已知M(K2Cr2O7)=294g·mol-1 , 计算结果保留三位有效数字]

已知:实验原理为。
将m g粗产品溶于无氧蒸馏水中配制成100 mL溶液,取20.00 mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min。用的
标准溶液进行滴定,加入指示剂,滴定至终点时,消耗
标准溶液。(杂质不与
反应,涉及的反应为
、
)
①加入的指示剂是(填名称)。
②C3N3O3Cl2Na的百分含量为(用含m、c、V的代数式表示)%。
③下列操作会导致粗产品中二氯异氰尿酸钠的纯度偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少

_
_
_
_
_
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是。
名称 | ||||
电位/V | 0.345 | 0.770 | 0.740 |
则SeO、Fe3+和Cu2+的氧化性由强到弱的顺序为,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。
已知:
①“酸浸”时和
与稀硫酸反应分别生成
和
。
②溶液中与
可相互转化:
, 且
为沉淀。
反应1:CH3COOH+SOCl2→CH3COCl+X↑+Y↑ ΔH<0
反应2:CH3COCl+CH3COOH→(CH3CO)2O+HCl↑ ΔH<0
已知:有关物质的部分信息如下。
物质 | 沸点/℃ | 相对分子质量 | 理化性质 |
乙酸(CH3COOH) | 118 | 60 | 易溶于水和有机溶剂 |
二氯亚砜(SOCl2) | 79 | 119 | 遇水水解,受热易分解 |
乙酰氯(CH3COCl) | 51 | 78.5 | 遇水或乙醇剧烈分解 |
乙酸酐[(CH3CO)2O] | 139.6 | 102 | 遇水形成乙酸,易溶于有机溶剂 |
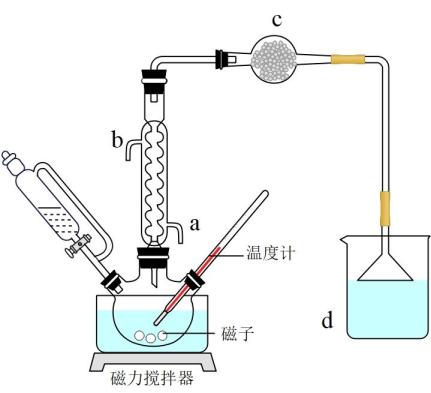
实验步骤:
I.将21.0g冰醋酸加入到三颈烧瓶中,再分批缓慢加入21.0gSOCl2 , 控制反应温度35℃,搅拌回流2小时。
II.将三颈烧瓶中的混合物转移至另一烧瓶中,提纯,收集到较纯的乙酸酐12.0g(其中乙酸酐占90.0%)。
实验装置如图所示:
回答下列问题:
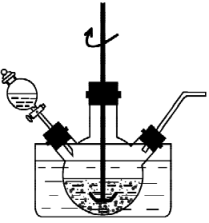
①将一定量“和石墨混合粉末”与
溶液、
溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是。
②转化为
的化学方程式为。
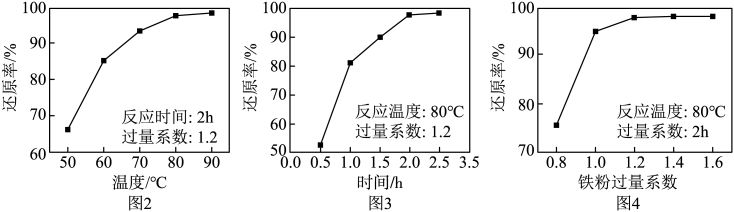
③保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有。
实验中须使用的试剂溶液、不锈钢片、
混合溶液,除常用仪器外须使用的仪器:直流电源。

a.50℃蒸发溶剂
b.100℃蒸发溶剂
c.抽滤
d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
f.蒸发至溶液出现大量晶体,停止加热