

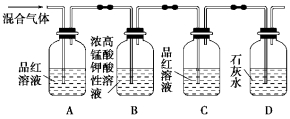
A | B | C | D | |
实验目的 | 实验室制乙酸乙酯 | 蒸干 | 苯萃取碘水中的 | 比较碳酸与苯酚酸性强弱 |
实验装置 |
|
|
|
|
选项 | 实验操作 | 现象 | 解释或所得结论 |
A | 向某无色溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 该无色溶液中含有SO |
B | 用pH计分别测定相同浓度的Na2S和NaCl溶液的pH | Na2S溶液的pH较大 | Cl的非金属性强于S |
C | 将pH=3的醋酸溶液稀释到原体积的100倍再测其pH | 3<pH<5 | 醋酸是弱酸 |
D | 将久置于空气中的NaOH固体溶于水,向其中加入BaCl2溶液 | 有白色沉淀生成 | 该NaOH固体已完全变质 |


选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 浓盐酸、浓硫酸 | 湿润的pH试纸 | 变红 | HCl为酸性气体 |
B | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
C | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3溶于水显碱性 |
D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| 选项 | 实验方案 | 实验目的 |
| A | 用少量NaOH溶液洗涤乙酸乙酯粗品 | 除去粗品中的乙酸 |
| B | 用排水法收集铜与稀硝酸反应生成的气体 | 收集NO |
| C | 将FeCl3·6H2O溶于热水中,然后冷却稀释 | 配制FeCl3溶液 |
| D | 将可能含有乙烯的SO2气体通入溴水中 | 验证气体中含有乙烯 |
| 选项 | A | B | C | D |
| 溶液 | Na2SO3溶液. | FeSO4溶液 | KI溶液 | NaOH溶液 |
| 所选试剂 | BaCl2溶液 | KSCN溶液 | AgNO3溶液 | 高锰酸钾溶液 |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
| D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向同体积同浓度的H2O2溶液中,分别加入1mol·L-1的氯化铜和氯化铁溶液,加氯化铁溶液的H2O2分解的快 | 铁离子对H2O2分解速率的影响比铜离子大 |
| B | 向饱和Na2CO3溶液中通入足量CO2 , 溶液变浑浊 | 析出了NaHCO3 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热,得到蓝色溶液 | 蔗糖水解产物没有还原性 |
| D | 向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr) | Ksp(AgBr)<Ksp (AgCl) |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 室温下,向铝箔上滴加浓硫酸 | 无明显现象 | 铝与浓硫酸不反应 |
| B | 将二氧化硫通入紫色石蕊试液 | 先变红后褪色 | 二氧化硫是酸性氧化物,还具有漂白性 |
| C | 在氯化银悬浊液中滴加少量KBr稀溶液 | 白色浑浊变为淡黄色浑浊 | Ksp(AgCl)>Ksp (AgBr) |
| D | NaAlO2溶液中滴加 NaHCO3溶液 | 产生白色沉淀 | N aAlO2和Na HCO3发生相互促进的水解反应 |
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气与氯化氢反应生成固体物质 |
| B | 常温下,将洁净的铁片放入浓硫酸或浓硝酸中 | 无明显变化 | 常温下,浓硫酸、浓硝酸使铁片钝化 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 向某无色溶液中滴加盐酸 | 产生能使澄清石灰水变浑浊气体 | 说明溶液中一定含有CO32- |
|
|
方案设计 |
现象和结论 |
|
A |
先加入少量KClO3溶液,再加 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
B |
加到少量 |
若溶液褪色,则样品为亚硝酸钠 |
|
C |
先加到少量 |
若溶液变黄色,则样品为亚硝酸钠 |
|
D |
先加入少量 |
若产生白色沉淀,则样品为亚硝酸钠 |
|
实验 |
操作与现象 |
|
① |
在 |
|
② |
在 再滴加 |
|
③ |
在 将上述混合液分成两份,一份滴加 另一份煮沸,产生红褐色沉淀。 |
依据上述实验现象,结论不合理的是( )
选项 | 实验目的 | 实验设计 |
A | 除去CH4中的CH2=CH2 | 气体依次通过盛有高锰酸钾溶液、浓硫酸的洗气瓶 |
B | 测定次氯酸钠溶液的pH | 将待测液滴在湿润的pH试纸上,再与标准比色卡对照 |
C | 探究浓度对化学反应速率的影响 | 取大小、形状、质量相同的Cu粒分别投入稀硝酸和浓硝酸中 |
D | 制取H2 | 向稀硫酸中加入Zn和少量Cu单质 |
Ⅰ.取已知浓度的溶液,搅拌下滴加足量
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量
固体,制得
和
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:



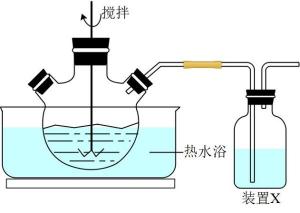
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
开始沉淀pH | 7.6 | 1.5 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 9.8 |
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。