
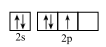
 C . NaOH的电子式:
C . NaOH的电子式:
实验 | 实验操作和现象 |
1 | 用pH试纸测定0.1mol·L-1Na2SO3溶液的pH,测得pH约为10 |
2 | 向0.1mol·L-1Na2SO3溶液中通入少量SO2 , 测得溶液pH约为8 |
3 | 用pH试纸测定0.1mol·L-1NaHSO3溶液的pH,测得pH约为5 |
4 | 向0.1mol·L-1Na2SO3溶液中通入少量Cl2 , 无明显现象 |
下列说法不正确的是( )
反应Ⅰ:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1= −128.8 kJ·mol-1
反应Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2= −41.8 kJ·mol-1
向一恒容密闭容器中投入一定量的CO和H2发生上述反应,CO的平衡转化率与温度、投料比α[α =]的关系如图所示。

下列有关说法正确的是( )

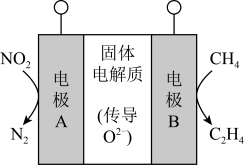
①电解过程中需要充分搅拌Ni(OH)2悬浊液的目的是。
②Ni(OH)2悬浊液中加入一定量KCl可显著提高NiOOH产率,原因是。
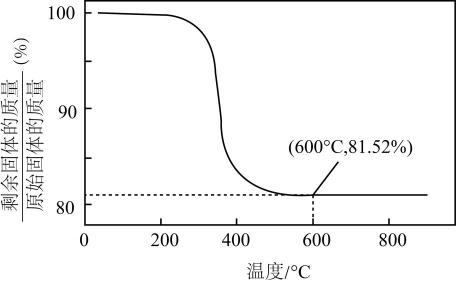
已知NiOOH加热至600 ℃后固体质量保持不变,则600 ℃时,剩余固体的成分为(填化学式)。
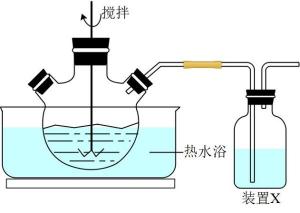
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
开始沉淀pH | 7.6 | 1.5 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 9.8 |
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。

①能与FeCl3溶液发生显色反应。
②分子中不同化学环境的氢原子个数比是1∶2∶9∶18。
 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是。

①写出NO与ClO反应的离子方程式:。
②烟气中含有少量SO2 , 能提高NO的脱除率,可能原因是。
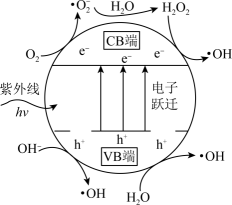
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是。