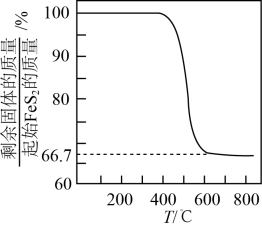
容器 | 甲 | 乙 | 丙 |
容积/L | 0.5 | 0.5 | 1.0 |
温度/℃ | |||
反应起始量 | 1.5mol A,0.5mol B | 1.5mol A,0.5mol B | 6.0mol A,2.0mol B |

下列说法正确的是( )

已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。

反应1:
反应2:
反应3:
反应4:
①计算并判断该反应的自发性。
②温度控制不当,气相产物之间会发生积碳副反应如下:
,
;
从而影响氢气产率。若仅考虑积碳副反应,一定温度下,测得在1.0MPa恒压反应体系中组分的分压(即组分的物质的量分数×总压)。达平衡时, , 则平衡常数
。
③生产过程中,为减小积碳对氢气产率及催化剂的影响,下列措施合适的是。
A.通入过量的氧气 B.通入适量的水蒸气 C.选择合适的催化剂 D.加压
④上述各反应达平衡时,体系中各物质的摩尔分数(物质的量分数)受温度的影响如图所示,请结合图像解释在图示温度范围内随着温度升高的摩尔分数先迅速上升后缓慢下降的原因是。


若想尽可能进行路径1,则选择的氧化物M-O键结合力应较(填“强”或“弱”);请补充完整反应的历程:(*表示吸附态)
……;
+;;
,
化学键 | H—H | C=O | H—O | C—H | C—O |
E(kJ/mol) | 436 | 745 | 465 | 413 | 351 |
写出二氧化碳催化加氢制甲醇的热化学方程式。

①该过程容易产生副产物。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式:。
反应a:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1;
反应b:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0。
在传统的催化固定反应床(CFBR)中,CO2转化率和甲醇选择性通常都比较低,科学团队发展了一种具有反应分离双功能的分子筛膜催化反应器(MR)用于CO2催化加氢制备甲醇,极大地改善了该问题,原理如图所示。

保持压强为5MPa,向密闭容器中投入一定量CO2和H2 , 不同反应模式下CO2的平衡转化率和甲醇选择性的相关实验数据如表所示。
实验组 | 反应模式 | 压强/MPa | 温度/℃ | CO2转化率 | CH3OH选择性 | |
① | CFBR | 3 | 5 | 250 | 25.6 | 61.3 |
② | CFBR | 3 | 5 | 230 | 20.0 | 70.0 |
③ | CMR | 3 | 3 | 260 | 36.1 | 100 |
已知CH3OH选择性:转化的CO2中生成CH3OH的百分比。
CFBR模式时,投料比=3一定温度下发生反应,下列说法能作为反应a达到平衡状态的判据是____(填选项字母)。
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则
=。


①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“
”或“
”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | H2(g)+ | 685 | 970 |
② | 2CH3OH(1) + 3O2(g)=2CO2 (g) +4H2O (1) | 3526 | 4978 |
CO2与H2合成液态甲醇的热化学方程式为。

①0~ 20 min内,用CH3OH的浓度变化表示的平均 反应速率:v(CH3OH)= mol·L-1·min-1。
②该温度下,反应的平衡常数K= (结果保 留两位小数)。
③若在上述平衡状态下,再向容器中充入1mol CO2和1molH2O(g),则反应速率 v(正)v(逆) (填“>”“< “或“= “)。


则合成氨反应的热化学方程式为。

前20min内 , 放出的热量为,25min时采取的措施是。
①该反应的平衡常数是。
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol , 则此时平衡(填“正向移动”“逆向移动”或“不移动”)
①298K,101kPa下,下列反应
则反应能自发进行的条件是。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)。
A.在制备阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫磺粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在转化为
阶段,控制温度在500℃左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
①某温度下,假设进入接触室内的物质的量恒定。当
和
的物质的量比为1∶1,反应达到平衡时压强减少1/5;保持温度不变欲使
的平衡转化率提高到90%,则
和
的物质的量比为应为(计算结果保留1位小数)。
②催化氧化
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:。
步骤Ⅲ:
当稀释时,
的值(增大、减小或不变),理由是。
该反应能自发的条件是(填“低温”或“高温”)。

①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②t=250℃时,当x(CH3OH)=0.10时,的平衡转化率
,(保留小数点后一位)此条件下该反应的Kp=。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。

合成氨反应的热化学方程式为。
①的转化率。
②反应I的平衡常数K为。
III.(主反应)
IV.(副反应)
在一定条件下发生反应的能量关系如图所示

①当反应一定时间,测得副产品的含量特别高,分析原因。
②为提高反应Ⅲ生成的选择性(转化的
中生成二甲醚的百分比),下列措施中合适的是。
A.适当增大压强 B.升高温度
C.使用合适催化剂 D.未达平衡时及时分离产品

则A、B结构是、。
反应I:CaS(s)+3NO2(g)=CaO(s)+SO2(g)+3NO(g) △H=-279.12kJ·mol-1 K1
反应II:CaS(s)+4NO2(g)=CaSO4(s)+4NO(g) △H=-714.52kJ·mol-1 K2
反应III:CaSO4(s)+NO(g)=CaO(s)+SO2(g)+NO2(g) △H K3
①三个反应的平衡常数的lnK随温度变化关系如图所示,则表示lnK2的曲线是。

②在恒温条件下,加入反应物,一段时间后达到平衡时c(SO2)如图所示,t1时减小容器体积,t2时达到新平衡,请画出t1至t2时c(SO2)变化趋势图。


①温度比较:气流a气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:。
③下列说法正确的是。
A.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.N2(g)+3H2(g)2NH3(g) △H=-92.4kJ·mol-1反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出NH3
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
|
共价键 |
H-Br |
O=O |
H-O |
Br-Br |
|
键能(kJ·mol-1) |
363 |
498 |
467 |
193 |
上述反应中,ΔH=kJ·mol-1。
|
实验序号 |
c(HBr)/mol·L-1 |
c(O2)/mol·L-1 |
正反应速率 |
|
1 |
0.1 |
0.1 |
v |
|
2 |
0.1 |
0.2 |
2v |
|
3 |
0.2 |
0.4 |
8v |
|
4 |
0.4 |
x |
32v |
①x=,a=,b=。
②有人提出如下反应历程:
(I)HBr+O2→HO-OBr(慢反应)
(II)HO-OBr+HBr→H2O+BrOBr(较快反应)
(III)BrOBr+HBr→BrOH+Br2(快反应)
(IV)BrOH+HBr→Br2+H2O(快反应)
活化能最大的反应是(填代号)。

①已知:CO2(g)和H2O(g)的生成焓为- 394 kJ/mol 和- 242 kJ/mol, 则△H =kJ/ mol,(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)。
②若要此反应自发进行, ( 填“高温”或“低温” )更有利。

某实验室模拟该反应,在2L恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1℃,反应开始时压强为800kPa,平衡时容器内气体总压强增加30%,则用平衡分压代替其平衡浓度表示化学平衡常数Kp=kPa [已知:气体分压(p分) =气体总压(p总)×体积分数]。

①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=。

已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为。
已知:NO与Ca(OH)2不反应;

NOx的去除率=1-×100%
①在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:。
②当大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是。

①b点时,平衡体系中C、N原子个数之比接近。
②a、b、c三点CO的转化率从小到大的顺序为;b、c、d三点的平衡常数从大到小的顺序为(以上两空均用a、b、c、d表示)。
③若=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为。
2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的△H=kJ·mol-1

①投料比一定时,要提高N2O平衡转化率,可采取的措施是。
②反应达到平衡前,在同温同压条件下的相同时间段内,N2O的转化率在使用催化剂2时比使用催化剂1要高,原因是。
③在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入1molN2O、4molCO和相同催化剂,发生上述反应。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。
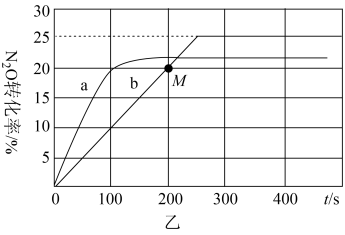
Ⅰ.曲线b中,从反应开始到M点处,用N2O表示的反应速率为mol/(L·s)。
Ⅱ.容器B中N2O的转化率随时间的变化关系是图乙中的(填“a”或“b”)曲线。

①A、B、C三点中NO2的转化率最高的是(填“A”、“B”或“C”)点,理由是。
②C点时该反应的压强平衡常数Kp=MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。


①曲线Ⅰ中,a点右侧乙烯产量随温度升高而降低的原因是。
②两种催化剂比较,催化剂Ⅱ的优点与不足是。
反应I:CH4(g)+ H2O(g) CO(g) +3H2(g) △H1=+206 kJ·mol-1
反应II:CH4(g)+ 2H2O(g) CO2(g)+4H2(g) △H2=+165 kJ·mol-1
反应III:CO(g)+ H2O(g) CO2(g)+H2(g) △H3
回答下列问题:



在某温度下达到平衡,测得密闭系统中各组分浓度分别为、
、
, 计算该温度下的平衡常数K=。
Ⅰ
Ⅱ
总反应:
Ⅲ
投料按体积之比 , 并用
稀释;常压、不同温度下反应相同时间后,测得
和
的体积分数如下表:
|
温度/ |
950 |
1000 |
1050 |
1100 |
1150 |
|
|
0.5 |
1.5 |
3.6 |
5.5 |
8.5 |
|
|
0.0 |
0.0 |
0.1 |
0.4 |
1.8 |
请回答:
①反应Ⅲ能自发进行的条件是。
②下列说法正确的是。
A.其他条件不变时,用替代
作稀释气体,对实验结果几乎无影响
B.其他条件不变时,温度越高,的转化率越高
C.由实验数据推出中的
键强于
中的
键
D.恒温恒压下,增加的体积分数,
的浓度升高
③若将反应Ⅲ看成由反应Ⅰ和反应Ⅱ两步进行,画出由反应原料经两步生成产物的反应过程能量示意图。

④在、常压下,保持通入的
体积分数不变,提高投料比
,
的转化率不变,原因是。
⑤在范围内(其他条件不变),
的体积分数随温度升高发生变化,写出该变化规律并分析原因。
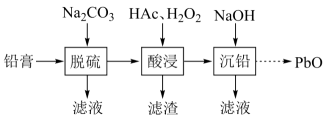
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。


①在A、B、C三种催化剂的作用下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C) ,根据图3曲线,判断三种催化剂条件下,活化能由小到大的顺序为。
②在氨气足量时,反应在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图4所示,据图可知,在相同的时间内,温度对脱氮率的影响是,其可能的原因是(已知A、B催化剂在此温度范围内不失效)。
t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
p/kPa | 400 | 370 | 346 | 330 | 320 | 320 |
假设反应在恒定温度和标准压强下进行,则= (标准平衡常数
, 其中
为标准压强(1 ×105 Pa),
和
, 为各组分的平衡分压,如
=
·p总 , p总为平衡总压,
为平衡系统中NO的物质的量分数)。


图中表示的微粒:a为,d为。

①该反应的△H (“>”或“<”)0。
②600℃时,平衡分压p(I2)= MPa,反应的平衡常数Kp= (Kp为以分压表示的平衡常数)。
第一步:I22I(快速平衡)
第二步:I+H2H2I(快速平衡)
第三步:H2I+I 2HI (慢反应)
①第一步反应 (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)•cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= (用含k1、k-1、k2…的代数式表示)。