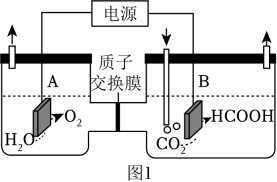
请回答:
Ⅰ:C(s)+O2(g)═CO2(g) | ΔH1=﹣393.5kJ•mol﹣1 |
Ⅱ:C(s)+H2(g)+O2(g)═HCOOH(g) | ΔH2=﹣378.7kJ•mol﹣1 |
Ⅲ:CO2(g)+H2(g)⇌HCOOH(g) | ΔH3 |
①ΔH3=kJ•mol﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0mol•L﹣1 , 平衡常数K=2.4×10﹣8 , 则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00mol•L﹣1氨水和0.18mol•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH=。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
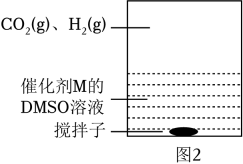
Ⅳ:M+CO2⇌Q | E1 |
Ⅴ:Q+H2⇌L | E2 |
Ⅴ:L⇌M+HCOOH | E3 |
①催化剂M足量条件下,下列说法正确的是 ____。
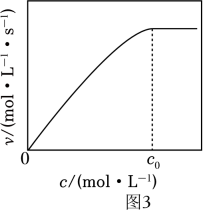
②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因。
微信扫码预览、分享更方便