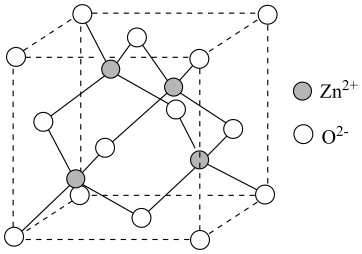
①基态的
电子轨道表示式为。
②完成反应的离子方程式:
用浓度分别为的
溶液进行了三组实验,得到
随时间t的变化曲线如图。
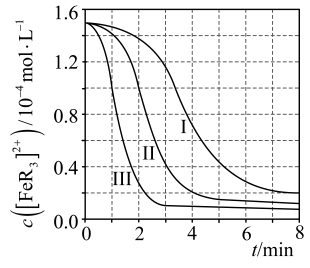
①时,在
内,
的平均消耗速率=。
②下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.平衡转化率:
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:
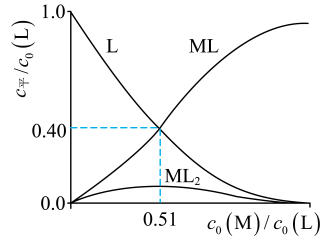
研究组配制了L起始浓度与L起始浓度比
不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种
中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
| | | |
0 | 1.00 | 0 | 0 |
a | x | | 0.64 |
b | | 0.40 | 0.60 |
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“”表示未检测到。
①时,
。
②时,平衡浓度比
。
Ⅰ:C(s)+O2(g)═CO2(g) | ΔH1=﹣393.5kJ•mol﹣1 |
Ⅱ:C(s)+H2(g)+O2(g)═HCOOH(g) | ΔH2=﹣378.7kJ•mol﹣1 |
Ⅲ:CO2(g)+H2(g)⇌HCOOH(g) | ΔH3 |
①ΔH3=kJ•mol﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0mol•L﹣1 , 平衡常数K=2.4×10﹣8 , 则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00mol•L﹣1氨水和0.18mol•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH=。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
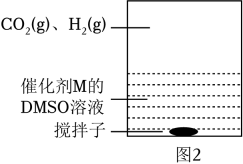
Ⅳ:M+CO2⇌Q | E1 |
Ⅴ:Q+H2⇌L | E2 |
Ⅴ:L⇌M+HCOOH | E3 |
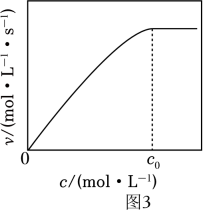
①催化剂M足量条件下,下列说法正确的是 ____。
②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因。
化学键 | ||||
键能/( | 414 | 803 | 463 | 498 |
为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号 |
|
| 催化剂的比表面积/( | |
① | 280 | 82 | ||
② | ||||
③ | 350 | a | 82 |
控制变量是科学研究的重要方法,因此表中数据:,
。
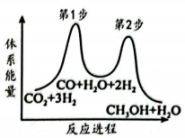
①第步(填“1”或“2”)是上述反应的决速步。
②恒容时,下列措施中能使该平衡体系中增大且加快化学反应速率的是(填字母)。
A.充入He(g),使体系压强增大 B.升高温度
C.将从体系中分离出去 D.再充入
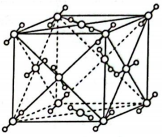
③干冰()的晶胞结构如图所示,若该晶胞边长为apm,则干冰晶体的密度为
。(已知:
;
表示阿伏加德罗常数的值)
时间/min | 0 | 3 | 5 | 10 | 15 |
浓度 | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
测得该条件下平衡时体系的压强为P,求该反应的(物质的分压=总压×物质的量分数)。
以一定流速通过催化剂,某温度下,得到的转化率、
或CO的选择性[
]与催化剂中NiO质量分数的关系图:
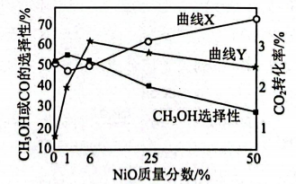
①曲线(填“X”或“Y”)表示的转化率随催化剂中NiO的质量分数的变化。
②有利于提高选择性的反应条件是(填标号)。
A.减小压强 B.使用更合适的催化剂 C.原料气中掺入适量的CO
Ⅰ.合成甲醇:
;
;
Ⅱ.逆水煤气反应:;
;
Ⅲ.成气合成甲醇:;
;
回答下列问题:
①基态的3d电子轨道表示式为。
② ,
(用
,
表示)。
物质的量/mol |
|
| |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 | |
①在℃条件下5-10min内,以
表示的该反应速率
,该条件下的平衡常数K=。
②下列说法正确的是。
A.
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
温度(K) | 催化剂 |
| 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对的转化为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(填字母符号)。
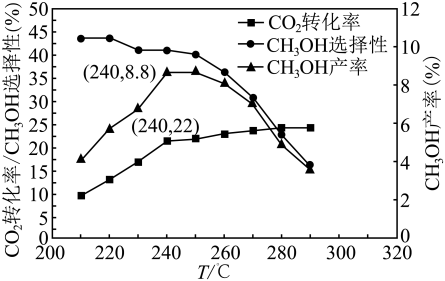
①转化率随温度升高而增大的原因可能是。
②选择性随温度升高而减小的原因可能是。
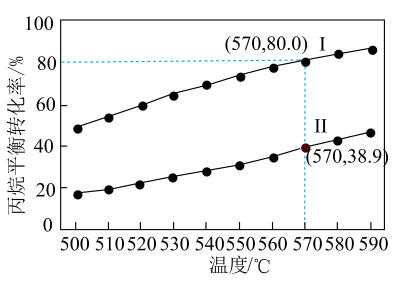
①直接脱氢:
②
计算氧化丙烷脱氢反应③
的
。
化学键 | |||
键能 | 347.7 | 413.4 | 436.0 |