Ⅰ:C(s)+O2(g)═CO2(g) | ΔH1=﹣393.5kJ•mol﹣1 |
Ⅱ:C(s)+H2(g)+O2(g)═HCOOH(g) | ΔH2=﹣378.7kJ•mol﹣1 |
Ⅲ:CO2(g)+H2(g)⇌HCOOH(g) | ΔH3 |
①ΔH3=kJ•mol﹣1。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0mol•L﹣1 , 平衡常数K=2.4×10﹣8 , 则CO2的平衡转化率为 。
③用氨水吸收HCOOH,得到1.00mol•L﹣1氨水和0.18mol•L﹣1甲酸铵的混合溶液,298K时该混合溶液的pH=。[已知:298K时,电离常数Kb(NH3•H2O)=1.8×10﹣5、Ka(HCOOH)=1.8×10﹣4]
Ⅳ:M+CO2⇌Q | E1 |
Ⅴ:Q+H2⇌L | E2 |
Ⅴ:L⇌M+HCOOH | E3 |
①催化剂M足量条件下,下列说法正确的是 ____。
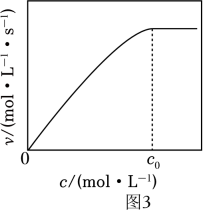
②实验测得:298K,p(CO2)=p(H2)=2MPa下,v随催化剂M浓度c变化如图3。c⩽c0时,v随c增大而增大:c>c0时,v不再显著增大。请解释原因。
①
②
③
④
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:i.CO2和H2S的初始物质的量相等:
ii.产率=转化率×选择性:
iii.COS的选择性 , H2O的选择性
。
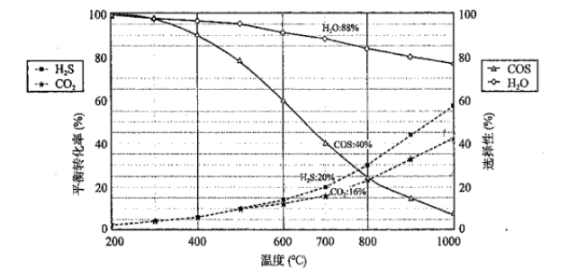
回答下列问题:

 B .
B .  C .
C . 
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能


上述平衡时 , 向体系通入
气,重新达到平衡时,
, 则ab(填“>”“<”或“=”)。(已知反应
的
, 物质
的摩尔分数
)

NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
SO2(g)+O2(g)
SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。

a.升高温度 b.增大压强 c.加入催化剂

根据上述实验结果,可知,
。
则的
。


①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。
Ⅱ.副反应CO2(g)+ H2(g) =CO(g)+ H2O(g) ΔH2= + 41 kJ/mol
回答下列问题:
已知:
①H2(g)+O2(g) = H2O(g) ΔH = -242 kJ/mol
②CH3OH(g) +O2(g) = CO2(g) + 2H2O(g) ΔH = -677 kJ/mol
则ΔH1 =kJ/mol, 该反应在(填“低温”或“高温”)易自发进行。

已知: CH3OH的选择性=
①用各物质的平衡分压p(B)表示反应I的平衡常数表达式Kp=;
②该反应体系中的催化剂活性受温度影响变化不大。图中表示CH3OH选择性变化的曲线是 (填 “a”或“b”),其原因是。
③当T= 250℃时,H2的平衡转化率α(H2)=。
(i) 2CO2+2e →
(ii)→
+ CO2
(iii) +
→2
+C
电池的正极反应式为。

决定该过程的总反应速率的基元反应方程式为。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2= kJ·mol-1

a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d. 比值不再发生变化

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是 (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=(MPa)-2(用最简分数表示)。
已知:
①H2(g)、CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1和-726.5kJ·mol-1
②CH3OH(l)⇌CH3OH(g) ΔH=+38kJ·mol-1
③H2O(l)⇌H2O(g) ΔH=+44kJ·mol-1
则反应CO2(g)+3H2(g)⇌CH3OH(l)+H2O(g)的ΔH1=kJ·mol-1。
I.CO2(g)+3H2(g)⇌CH3OH(l)+H2O(g) ΔH1
II.CO2(g)+H2(g)⇌CO(g)+H2O ΔH2=+41kJ·mol-1
一定条件下向某刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应,在不同催化剂(catl,cat2)下经相同反应时间,CO2转化率和甲醇的选择性[甲醇的选择=×100%]随温度变化如图甲所示:

①由图可知,催化效果catlcat2(填“>”“<”或“=”)。
②在210℃-270℃间,CH3OH的选择性随温度的升高而下降,可能原因为。
③某条件下,达到平衡时CO2的转化率为15%,CH3OH的选择性为80%,则H2的平衡转化率为;反应II的平衡常数Kp=(列出算式即可)。

物质 | CO | |||
|

方法a:“二步法”制二甲醚
I:
Ⅱ:
方法b:“一步法”制二甲醚
Ⅲ:
两种方法都伴随副反应:
Ⅳ:
请回答:

(的选择性
,
的选择性
)
①下列说法正确的是
A.当反应达到平衡时,
B.曲线①表示二甲醚的选择性
C.温度越低越有利于工业生产二甲醚
D.工业上引入双功能催化剂是为了降低反应Ⅲ的
②在的范围内,
的平衡转化率先降低后升高的原因:。




下列说法正确的是
反应: 2C4H8 (g) +O2 (g) =2C4H6 (g) +2H2O (g) ΔH
副反应①: C4H8(g) +6O2 (g) =4CO2 (g) +4H2O (g) ΔH =-2542.6kJ·mol-1
副反应②: 2C4H6 (g) +11O2 (g) =8CO2 (g) +6H2O (g) ΔH2= -4886.6kJ·mol-1


氧烯比固定,温度升高,丁烯单位时间内转化率先增大后无明显变化的原因是; 丁
丁二烯最佳的温度和氧烯比分别为;

则1molN-H键断裂吸收的能量为kJ。
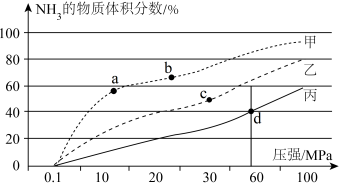
甲、乙、丙中温度从高到低的顺序是。d点N2的转化率是,d点Kp=(Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。


Ⅰ.
Ⅱ.
回答下列问题:
①当转化率达到60%时,反应达到平衡状态,这时
和
的平均相对分子质量为23,若反应Ⅱ的
, 平衡时反应速率
;
②经验公式为
, 其中
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
(用含
、
、T、R的代数式表示)。
③由实验测得,随着温度的逐渐升高,反应Ⅰ为主反应,平衡逆向移动平衡时混合气体的平均相对分子质量几乎又变回16,原因是。

由图可知,温度相同时选择性的实验值略高于其平衡值,可能的原因是。
a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示:

已知时,
, 平衡体系总压强为P,则
反应c的平衡常数
。
用氧化烟气中的
时,体系中存在以下反应:
a)
b)
c)
根据盖斯定律,。
d)
e)
不同压强(p)下,的平衡转化率
随反应温度(T)的变化关系如下图所示:

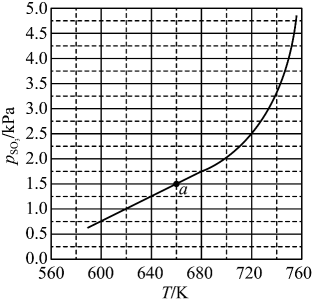
①由图可知,0(填“大于”或“小于”下同),
。
②下列有关该反应体系的说法正确的是(填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大的浓度,反应d、e的正反应速率均增大
③某温度下,平衡时的物质的量分数为
, 且
与
的物质的量分数相等,此时
mol。
光照条件下,催化剂表面产生电子(
)和空穴(
)。电子与
作用生成离子自由基(
),空穴与水电离出的
作用生成羟基自由基(
),
和
分别与
反应生成
。变化过程如下图所示:

一定范围内,NO脱除速率随烟气湿度的增大而增大,结合催化剂的作用机理,分析可能的原因。
ⅰ.;
ⅱ.。
反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2

实验序号 | 1 | 2 | 3 |
CH4浓度/mol·L-1 | 0.1000 | 0.2000 | 0.2000 |
H2O浓度/mol·L-1 | 0.1000 | 0.1000 | 0.2000 |
速率/mol·L-1·s-1 | 3.75×10-4 | 1.50×10-3 | 3.00×10-3 |
若某时刻,测得c(CH4)=0.4000mol·L-1 , c(H2O)=0.4000mol·L-1 , 则此时的反应速率v正=。

①600℃时,若经过tmin,反应达到平衡。该条件下,反应I的Kp=(MPa)2(列出计算式即可)。
②H2的含量在740℃左右出现峰值的原因为。

①CH4参与的电极反应为。
②经测定,原料气中各气体的体积分数为:
气体 | H2 | CH4 | CO | CO2 |
体积分数 | 82% | 3% | 5% | 10% |
若电解过程中消耗了100m3的原料气,则可得到相同条件下纯净H2m3。
C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是 (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器

①表示v正的直线是 (填“A”或“B")。
②T ℃时,该反应的平衡常数K=。
③T ℃时,向刚性容器中充入一定量NO2 , 平衡后测得c(NO2)为0.1 mol·L-1 , 平衡时NO2的转化率为(保留一位小数)。平衡后v逆=(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2 , NO2的平衡浓度将 (填“增大”“减小”或“不变”)。

①该反应在一定温度下能自发进行的原因为。
②已知键能是指气态分子中1mol化学键解离成气态原子所吸收的能量,上述反应中相关的化学键键能数据如下:
化学键 | C-H | C≡O | H-H |
键能/(kJ·mol-1) | 413 | 1075 | 436 |
则CO2(g)=C(g)+2O(g) ΔH=kJ·mol-1。
i.CH4(g)+CO2(g)2H2(g)+2CO(g)
ii.H2(g)+CO2(g)H2O(g)+CO(g) ΔH=+41.2kJ·mol-1
若在恒温、恒容密闭容器中进行反应i、ii,下列事实能说明上述反应达到平衡状态的是____ (填字母)。
①平衡时容器的体积是起始时的倍。
②该温度下反应i的压强平衡常数Kp=(Kp为用分压表示的平衡常数,分压=总压×物质的量分数)。
③维持其他因素不变,若向平衡体系中通入一定量的N2(N2不参与反应),再次平衡后CH4的转化率 (填“增大”“减小”“不变”或“无法判断”,下同),。

在Rh表面,每生成1molCO,则价带产生的空穴(h+)数为NA;价带上的电极反应式可表示为。
①基于铁催化体系(添加了氧化铝和氧化钾)的反应机理及能量变化如图所示,据此计算反应的ΔΗ=。

②中科院大连化学物理研究所科研团队构筑了“过渡金属—LiH”双活性中心催化体系,显著提高了传统金属催化剂在温和条件下的合成氨性能,其反应过程分为以下三步(*表示催化剂的活性位点),据此写出Ⅱ的化学方程式。
I.;Ⅱ.;Ⅲ.
。

①a点对应的转化率:(填“>”“<”或“=”,下同);
。
②c点对应的小于a点对应的
, 解释其原因为。
③a、b、e三点对应的压强平衡常数(、
和
)的大小关系为;a点对应的压强平衡常数
(用体系中各气体的分压来表示,分压=总压×物质的量分数)
乙醇胺
的电子式为。


“重整系统”发生反应的化学反应方程式为。
①
②ΔH2
已知键能如表所示:
化学键 | ||||||
键能 | 745 | 351 | 436 | 414 | 347 | 460 |
则=。

通电时,阳极有机产物是(填结构简式)。
C(s,石墨) +O2(g)=CO2(g) ΔH1= -393.5 kJ·mol-1
H2(g) +O2(g)=H2O(1) ΔH2= -285.8 kJ· mol-1
2C2H2(g) +5O2 (g)= 4CO2(g) +2H2O(1) ΔH3= -2599.0 kJ·mol-1
在298K时由C(s,石墨)和H2(g)反应生成1 mol C2H2(g) 的热化学方程式为。
主反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH1=-156.9kJ· mol-1
副反应:CO2(g) +H2(g) CO(g) + H2O(g) ΔH2= +41.1 kJ·mol -1
工业合成甲烷通常控制温度为500℃左右,其主要原因为。
CH4(g) +4NO(g) 2N2(g) +CO2(g) +2H2O(g) ΔH <0。
当=1时,NO的平衡转化率~
;T2时NO平衡转化率~
的关系如图

①能表示此反应已经达到平衡的是。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C. 不再变化
②表示T2时NO平衡转化率~的关系是(填“I”或“II”),T1T2(填“>”或“<”)。
③在=1、T2时,CH4的平衡分压为 。已知:该反应的标准平衡常数
, 其中
=100 kPa,p(CH4)、p(NO)、p(CO)2、 p(N2)和p( H2O)为各组分的平衡分压,则该温度下
=。(分压=总压 ×物质的量分数。计算结果用分数表示)。
①CO2(g)CO2(aq)
②CO2(aq)+H2O(1)H+(ag)+HCO
(aq) K
过程①的ΔH0(填“>”“<”或“=”)。溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为mol·L-1(忽略HCO和水的电离)。
反应I:C(s)+H2O(g)CO(g)+H2(g) ΔH1=+131.3kJ·mol-1 K1
反应II:C(s)+2H2O(g)CO2(g)+2H2(g) ΔH2=+90.3kJ·mol-1 K2
反应III:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.0kJ·mol-1 K3
上述反应的化学平衡常数随温度变化的关系如图所示,表示K1、K2、K3的曲线分别是c、、。

②研究表明,反应III的速率方程为v=k[x(CO)·x(H2O)-],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数,随温度升高而增大。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是。

主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
温度为T℃,压强为p0的恒压密闭容器中,通入2molCH4和1molCO2发生上述反应。平衡时H2O(g)的分压为p1 , 甲烷的转化率为40%。
①下列说法正确的是(填标号)
A.ΔH1和ΔH2不变,说明反应达到平衡状态
B.相同条件下,主反应的速率大于副反应,说明主反应的活化能小
C.选用合适的催化剂可以提高主反应的选择性,增大甲烷的平衡转化率
D.平衡后,若增大压强,主反应平衡逆向移动,副反应平衡不移动
②平衡时混合气体的总物质的量为mol,H2(g)的分压是(用含p0和p1的计算式表示)。


①选择时,温度高于260℃时NO转化率下降的原因为。
②综合分析,该脱硝过程应选择的最佳催化剂中M为。
③选用合适的催化剂还能抑制催化剂表面出现NH4HSO4结晶现象,结晶会导致。
①下列选项不能说明反应I、Ⅱ均达到化学平衡状态的是。
A.混合气体的平均摩尔质量保持不变 B.n(NH3)∶n(NO)保持不变
C.有1molN-H键断裂的同时,有键断裂 D.NO的分压保持不变
②达到平衡后测定O2转化率为30%,体系中NH3为1.2mol。则NO的转化率为,反应I的Kp=(写出计算式即可)(分压=总压×物质的量分数)。

该过程的能量转化形式为,在整个过程中, FeO 的作用是。
②C(s)+O2(g)=CO2(g) ΔH2=bkJ/mol
则过程1的热化学方程式为。
II.以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化: In2O3( 无活性) In2O3-x(有活性) ;
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3主反应
反应②: CO2(g)+H2(g)CO(g)+H2O(g) ΔH4副反应
a.升高温度,反应CO(g)+2H2(g)CH3OH(g)的化学平衡常数K (填“增大” “减小”或“不变”)。
b.恒温恒压密闭容器中,加入2molCO2和4molH2 , 只发生反应①和反应②,初始压强为P0。 在230℃以上,升高温度,CO2 的平衡转化率增大,但甲醇的产率降低,可能原因是 。在300℃发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp= ( 保留两位有效数字)。


该反应的化学平衡常数表达式是。根据图1,用N2表示该反应达平衡过程中的平均反应速率是mol/(L·min)。
a.其他条件不变,若充入N2 , 达到新平衡时,、
均增大
b.加入催化剂可提高NO的平衡转化率
c.若适当增大压强,则平衡正向移动
d.其他条件不变,若容器体积扩大一倍,达到新平衡时,c(N2)小于原来的一半
实验编号 | T(K) | NO的初始浓( | CO的初始浓度 ( | 催化剂的比表面积 ( |
I | T0 | 75 | ||
II | T0 | 50 |
在图3中画出表中实验II条件下混合气体中NO的浓度随时间变化的曲线。

甲醇和水蒸气制取氢气的过程中有下列反应:
kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式。
硼氢化钠()是研究最广泛的储氢材料之一
已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下在水中的溶解度为55 g,
在水中的溶解度为0.28 g
在配制溶液时,为了防止发生水解反应,可以加入少量的(填写化学式)。


①钛电极的电极反应式是。
②电解过程中,阴极区溶液pH(填“增大”“减小”或“不变”)
①尿素的合成分两步进行:
a.
b.
则总反应的ΔH=。
②如图为时,温度对
的转化率的影响。解释温度升高
的平衡转化率增大的原因:

①甲醇还可以与乙酸反应制香料,反应方程式为 , 制香料反应的平衡常数K的表达式为。
②850℃时,反应的平衡常数K=160,在密闭容器中进行该反应,开始时只加入
、
, 反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
物质 | ||||
浓度/( | 0.2 | 0.2 | 0.4 | 0.4 |

①从反应开始至达到化学平衡时,以表示的平均化学反应速率为
。
②若该反应的正、逆反应速率分别可表示为 ,
,
、
分别为正、逆反应速率常数, A、B两点对应的时刻,该反应的正反应速率之比
。
③若平衡时总压强为pkPa,用平衡分压代替其平衡浓度表示的化学平衡常数 [已知:气体分压(
)=气体总压(
)×该气体的体积分数]。
化学键 | N≡N | H-H | N-H |
键能/(kJ·mol-1) | 946 | 436 | 390.8 |
①T℃时, 2NH3(g)⇌N2(g)+3H2(g)的ΔH =。
②T℃时,在1L密闭容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4 mol 、2 mol 、4 mol,则此时反应v正(N2)v逆(N2)(填“>”“<”“=”或“不能确定” )。

①为进一步提高NH3的平衡转化率,下列措施能达到目的的是(填字母)。
A.增大CO2的浓度 B.增大压强
C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)⇌NH2COONH4 (1) ΔH =-117 kJ/mol
b.NH2COONH4(1)⇌CO(NH2)2(1)+H2O(g) ΔH = +15 kJ/mol,
第一步反应速率快,可判断活化能较大的是 (填“第一步”或“第二步”)。
③某实验小组为了模拟工业合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应: 2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数(MPa)-2(已知:分压=总压 ×体积分数)。
