①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
①C,CO ②S,SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2 .
![]()
①NO(g)+Br2(g)⇌NOBr2(g)慢
②NO(g)+NOBr2(g)⇌2NOBr(g)快
下列有关该反应的说法正确的是( )
①N2(g)+O2(g)⇌2NO(g) K1=1×10﹣30
②2H2(g)+O2(g)⇌2H2O(g) K2=2×1081
③2CO2(g)⇌2CO(g)+O2(g) K3=4×10﹣92
下列说法正确的是( )
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJ•mol﹣1
③ H2SO4(1)+NaOH(1)═
Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
⑤CO(g)+ O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJ•mol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJ•mol﹣1
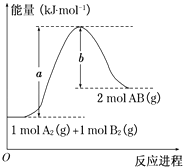
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:

试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 时数 据 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).
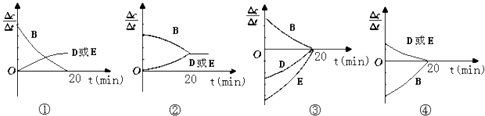
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE