 B . 高锰酸钾扩散
B . 高锰酸钾扩散  C . 蜡烛燃烧
C . 蜡烛燃烧  D . 干冰升华
D . 干冰升华 



x | y | |
A | NaOH 溶液 | 稀 HCl(过量) |
B | 稀 H2SO4 | BaCl2 溶液(少量) |
C | Ca(OH)2 | CO2(适量) |
D | 稀 H2SO4 | H2O |
 B .
B .  C .
C .  D .
D . 
选项 | 物质 | 操作方法 |
A | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
B | CaO 粉末(CaCO3 粉末) | 加足量的水,充分搅拌后过滤 |
C | NaOH 溶液(Ca(OH)2 溶液) | 通入过量 CO2 气体,充分反应后过滤 |
D | CuSO4 溶液(硫酸) | 加入过量 CuO 粉末,加热,充分反应后过滤 |
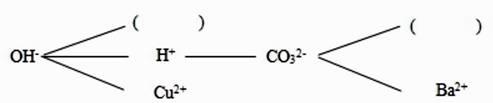



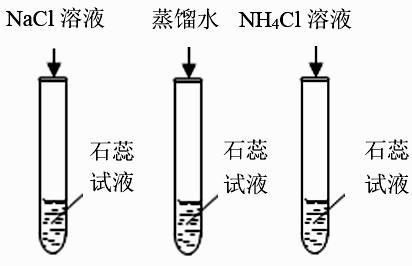
于是他设计以下实验进行探究。
在烧杯中加入约 5mL 氢氧化钠溶液,滴入几滴酚酞溶液,再向溶液中滴加稀盐酸,至溶液全部变成无色。
【提出问题】反应中氢氧化钠和盐酸恰好完全中和吗?
【作出猜想】大家针对反应后溶液中所含溶质的成分作出了如下猜想:
猜想一:只含有 NaCl;
猜想二:含有 NaCl 和 NaOH;
猜想三:含有 NaCl 和 HCl。
实验方案编号 | 实验一 | 实验二 | 实验三 |
实验操作 | 用镊子夹取一片 pH 试纸, 浸入烧杯的溶液里,片刻后取出,把试纸显示的颜色与标准比色卡比较 | 用试管取样品溶液约 1mL,滴加AgNO3 溶液 | 用试管取样品溶液约1mL,滴加Na2CO3 溶液 |
实验现象 | pH=2 | 产生白色沉淀 | —— |
实验结论 | —— | 溶液中有 HCl | 溶液中有 HCl |
【评价与反思】经过分析,同学们认为实验中存在两处明显错误:
①实验操作中的错误是。
②实验方案中也有一个是错误的,错误的原因是。
 【提出问题】这瓶溶液是什么溶液?
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
①小丽取样滴加无色酚酞试液,溶液呈红色,得出结论:该溶液不可能是氯化钠溶液;
②小刚另取样滴加稀盐酸有气泡产生,小刚得出结论:该溶液是碳酸钠溶液;
③小青认为小刚的结论不完全正确,理由是。小组同学讨论后一致认为还需要进行如下实验:

【提出问题】氯化氢气体与盐酸的化学性质是否相同?
【查阅资料】
①氯化氢气体是由氯化氢分子构成的;
②在盐酸中存在氢离子、氯离子和水分子;
③氯化氢的甲苯溶液中氯化氢以分子的形式存在。
盐酸与氯化氢的甲苯溶液的微观示意图 2 所示。
【分析猜想】氯化氢与盐酸的化学性质不一致,进行以上猜想的理由是:。
【实验准备】为探究氯化氢与盐酸的化学性质,根据实验方案准备时发现缺少氯化氢的
甲苯溶液。化学兴趣小组的同学向老师求助,老师用图 3 所示装置和有关试剂为兴趣小
组制取了氯化氢的甲苯溶液。晴晴同学在协助老师制氯化氢的甲苯溶液时产生了疑问,
为什么浓盐酸加到浓硫酸中能产生大量的氯化氢气体?答:。
【进行实验】用盐酸和氯化氢的甲苯溶液进行对比实验。
实验内容 | 现象 | 解释 |
与氧化铜作用 | 盐酸: | 化学方程式:(略) |
氯化氢的甲苯溶液:没有明显现象 | 氯化氢在甲苯中没有解离出氢离子 | |
与碳酸钙粉末作用 | 盐酸:粉末消失,产生气泡 | 化学方程式:(略) |
氯化氢的甲苯溶液:没有明显现象 | 氯化氢在甲苯中没有解离出氢离子 |
【得出结论】盐酸与氯化氢气体的化学性质不一致。

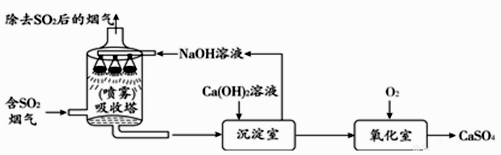
Ⅰ.电解饱和食盐水的化学方程式:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响。
探究活动:测定待测液中氢氧化钠的质量分数
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:2NaOH+MgCl2==Mg(OH)2↓+2NaCl
学习小组同学按如图所示的实验步骤进行实验:

第一步:制紫甘蓝汁:①将紫甘蓝在废塑料盒中捣烂,加入白酒浸泡一段时间;②将①中得到的不溶物与液体分离,(写具体做法),得到了自制的紫甘蓝汁;
第二步:小明欲用制得的紫甘蓝汁测出家中炉具清洁剂和厕所清洁剂的酸碱性,先上网查得下列资料(如表所示)。
在不同溶液中的颜色变化 | ||
盐酸 | 氢氧化钠溶液 | |
紫甘蓝汁 | 红色 | 黄色 |
第三步:小明取少量厕所清洁剂放入废塑料盒中,加入紫甘蓝汁,发现溶液变为红色,
得出厕所清洁剂显性;
小明认为紫甘蓝汁可以替代实验室中的石蕊溶液做酸碱指示剂。
①NH4NO3 ②NH4H2PO4 ③KNO3 ④K2SO4

①由实验 1 可确定原营养液中一定有的物质是。
②由实验 1 和实验 2 可推测原营养液(填“一定有”或“可能有”)KCl。
③若测得原营养液中 K+和 Cl-的数目之比为 1∶1,则原营养液的组成中的溶质是。


⑴确定要测定地块的采样点。
⑵将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
⑶对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的
阴离子都来自原土壤滤出液中)

⑷称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
请回答下列问题:


第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
电子天平的示数/g | 163.2 | 166.4 | 169.6 | 173.9 | 179.3 |
芳芳的解法:  明明的解法:
明明的解法: 
秀秀的解法: 