

(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
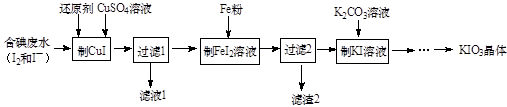
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O =2I- +S4O
。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据。

回答下列问题:
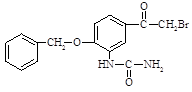
①已知A的分子式为C8H10O,其化学名称为。
②B中的官能团的名称为。
③由A生成C的化学反应方程式为,反应类型是。
④由D的结构可判断:D应存在立体异构。该立体异构体的结构简式为。
⑤若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与C反应,生成物的结构简式为。
⑥A的同分异构体中能与三氯化铁溶液发生显色反应的还有种:其中,核磁共振氢谱为四组峰,峰面积比为6:2:1:1的结构简式为。
②苯环上有羧基或酯基时,新取代基主要在间位。
结合上述合成路线,请设计以乙苯、ClCH2OH、(CH3)2NH为原料合成 ![]() 的合成路线(用流程图表示,无机试剂任选),示例如下:
的合成路线(用流程图表示,无机试剂任选),示例如下:
![]()
①有苯环;②核磁共振氢谱有4个峰。
①若参加反应的XY2的物质的量为0.01 mol,则生成的气体XO2和YO2的体积比为;
②若测得反应后混合气体的总体积为896 mL(STP),则反应前O2的物质的量为。

①该注射液的密度为g/cm3;
②该注射液中葡萄糖的物质的量浓度为。
①则该同学应在托盘天平上称取g十水碳酸钠晶体;
②配制所需Na2CO3溶液用到的玻璃仪器为;
③下列实验操作造成所配溶液的浓度偏低的是(填标号)。
A.忘记将洗涤液转移至容量瓶中
B.托盘天平的砝码生锈
C.容量瓶的内壁附有水珠而未进行干燥处理
D.定容时,俯视容量瓶的刻度线