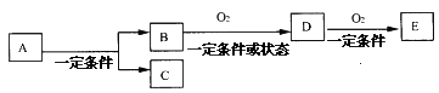
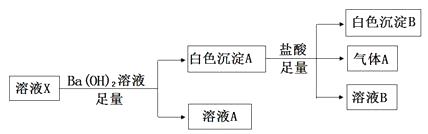
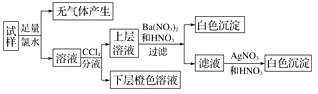
则下列关于原溶液的判断正确的是( )
写出核磁共振氢谱峰面积比为1:1:1:1:6的物质的结构简式:.
①能与NaHCO3反应并放出CO2 , ②能发生水解反应、银镜反应.
反应 | 大气固氮 N2(g)+O2(g)⇌2NO(g) | 工业固氮 N2(g)+3H2(g)⇌2NH3(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10﹣31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因

已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)⇌2H2O(l)△H=﹣571.6kJ•mol﹣1 .
①当x=5.0时,上述平衡向(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。

a.Ca(OH)2(s) Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43- Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是。

a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
将7.4 g某有机物A置于氧气流中充分燃烧,实验测得:生成9.0 g H2O和17.6 g CO2。
则该物质的最简式是,据此 (填“能”或“不能”)确定该有机物的分子式。若前一空选填“能”,请在后面横线上写出其分子式;若前一空选填 “不能”,请在后面横线上写出理由:。
核磁共振氢谱显示该有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出无色无味的气体,则A的结构简式为。
A在浓硫酸作用下加热至一定温度可生成不饱和烃B,请写出B发生加聚反应的反应方程式: 。
①水泥是最常用的建筑材料,它属于(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y , 其中x , y的数值分别是(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。

①食品添加剂中,属于无机盐的是(填化学式)。
②属于着色剂的是诱惑红和;属于防腐剂的是。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是;严格整治畜禽养殖场污染 , 主要是为减少和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式。
③阿司匹林作为一种药物,主要具有作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式。