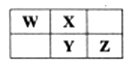
①X为(名称),Y为(元素符号),Z原子结构示意图为.
②N的最高价氧化物的水化物的化学式为.
③工业上制取单质M的化学方程式为.
①指出锌在周期表中的位置:第周期,第族,基态Zn原子的电子排布式.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.葡萄糖分子中碳原子杂化方式有.
A.激光 B.焰色反应 C.燃烧放热
D.原子光谱 E.霓虹灯 F.石墨导电
(2)A、B、C三种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍,C元素的基态原子L层有两个未成对电子.某直线形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有 个σ键, 个π键.
(3)CO的结构可表示为C≡O,N2的结构可表示为N≡N.下表是两者的键能数据:(单位:kJ/mol)
A﹣B | A=B | A≡B | |
C≡O | 357.7 | 798.9 | 1071.9 |
N≡N | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关.
①基态28Ni原子的核外电子排布式为 .
②Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
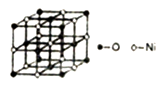
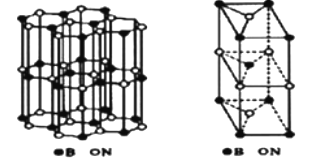
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgONiO(填“>”、“<”或“=”),理由是。
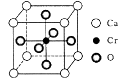
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
若其中有一半的Si被Al替换,其化学式为。