A | B | C | D | |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | HClO | Fe(OH)3 |
非电解质 | C12H22O11 | BaSO4 | C2H5OH | H2O |
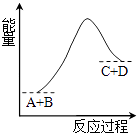
2Hg(l)+O2 (g)═2HgO(s)△H=﹣181.6kJ•mol﹣1
则反应Zn(s)+HgO(s)═ZnO(s)+Hg (l)的△H为( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②NO2与NO速率相等
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的压强不再改变的状态.
 B .
B .  C .
C .  D .
D . 
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水.
①容器体积不变,再充入NO2
②容器体积不变,再充入N2O4
③使体积增大到原来的2倍
④升高温度.

① P4(s,白磷)+
O2(g)═
P4O10(s)△H1=﹣745.8kJ•mol﹣1
②4P(s,红橉)+5O2(g)═P4O10(s)△H2=﹣2954kJ•mol﹣1
a.同一种物质 b.同位素 c.同分异构体 D.同素异形体