 C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 

| 选项 | 实验目的 | 实验操作 |
| A | 鉴别NH4HCO3和Cu(OH)2 | 观察颜色 |
| B | 除去CO2中少量的CO | 点燃 |
| C | 鉴别H2O和H2O2溶液 | 分别取少量液体于试管中,加入MnO2 |
| D | 除去Cu粉中少量的Fe粉 | 用磁铁吸引 |

①该实验测得氧气的体积分数约是%.与实际值进行对比,说明存在误差的可能原因是。
②燃烧结束时,试管里剩余气体的主要性质是。

①氧原子在化学反应中容易电子(填“得到”或“失去”)。
②硒元素能增强人体免疫力,延缓衰老,山药等食物中常含硒元素。硒(Se)在氧气中燃烧生成二氧化硒。回答下列问题:
A.硒原子的核电荷数为;
B.硒元素与氧元素、硫元素的化学性质相似,原因是它们的原子相同;
C.写出硒在氧气中燃烧的化学方程式。



①过程I是利用空气中各成分的不同,分离得到N2。
②过程Ⅱ中,N2和H2反应生成NH3 , 该反应为(填“化合”或“分解”)反应。
③过程Ⅲ中发生反应的化学方程式为4NH3+5O2 4NO+6H2O,若参加反应的NH3为68kg,理论上生成NO的质量为kg。
④过程Ⅳ发生反应的微观示意图如图:

过程Ⅳ发生反应的化学方程式为,反应中各物质的质量比为。
①元素的种类 ②物质的种类 ③原子的种类
④分子的种类 ⑤原子的数目⑥分子的数目
FeS2+O2 SO2+Fe2O3

①实验中观察到B、C实验前后天平依然保持平衡,某同学认为B、C实验都能验证质量守恒定律,请你帮助分析他的结论是否正确并说明理由。。
②C中的现象是。而A、D实验天平不平衡,其中D实验天平不平衡的原因是,A实验的化学方程式为。
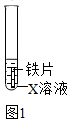
①若要证明Fe在金属活动性顺序中位于氢前,X溶液可选用,其现象为。
②若X溶液为少量硫酸铜溶液,该反应的化学方程式为。待充分反应后,取出铁片,放入金属R,观察到R表面有黑色固体析出。根据上述实验现象,得出Fe、Cu、R的金属活动性顺序为。

①纯净气体可以是CO.若黑色固体为,反应过程中B处可以观察到黑色固体的明显实验现象。
②纯净气体可以是CO.但B处无明显实验现象,则B处发生反应的化学方程式为。
③纯净气体和黑色固体的组合还可以是,则B处的实验现象为。
|
实验操作 |
实验现象 |
|
| A.红色物质附着于铝片表面 B.铝片表面逸出大量无色气体,放出大量的热 C.烧杯底部出现红色沉淀和白色沉淀 |
①现象A和现象C中的红色物质均为Cu,生成该物质的化学方程式为。
②经检验,现象B中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性。经实验检测,证实了甲的猜想。
③探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
(查阅资料)
★CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-
★Cu(NH3)2+在空气中易被氧化变为蓝色:Cl-可与硝酸银溶液反应,产生白色沉淀。
(进行实验)
步骤一:取烧杯底部的白色沉淀,充分洗涤;
步骤二:向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
步骤三:取其中一份无色溶液……
步骤四:将另一份无色溶液放置于空气中……
以上步骤三的实验方案是;
步骤四的现象是。
(得出结论)通过实验可以确定,该白色固体是CuCl。
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
④丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是。
⑤丁同学认为丙同学的实验还不够严谨,还应考虑对Cu与CuCl2溶液反应的影响。