金属学 | Ti | Mg | Cu |
金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
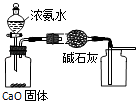 用此图装置制取并收集干燥纯净的NH3
B .
用此图装置制取并收集干燥纯净的NH3
B . 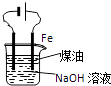 用此图装置实验室制备Fe(OH)2
C .
用此图装置实验室制备Fe(OH)2
C . 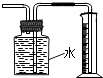 此图装置收集并测量Cu与浓硝酸反应产生的气体及体积
D .
此图装置收集并测量Cu与浓硝酸反应产生的气体及体积
D . 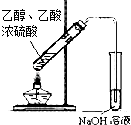 此图装置可用于实验室制取乙酸乙酯
此图装置可用于实验室制取乙酸乙酯
①无色溶液中:K+ Cl﹣ Mg2+ SO42﹣ Cr2O72﹣
②pH=11的溶液中:CO32﹣ Na+ AlO2﹣ NO3﹣ S2﹣
③水电离的H+浓度为10﹣2mol/L的溶液中:Cl﹣ CO32﹣ NH4+ SO32﹣ NO3﹣
④加入铝粉放出氢气的溶液中:K+ Cl﹣ Mg2+ S2O32﹣SO42﹣NH4+
⑤使甲基橙变红的溶液中:MnO4﹣Fe2+ Na+ NO3﹣SO42﹣
⑥中性溶液中:Fe3+ Al3+ NO3﹣ Cl﹣
⑦能溶解铜粉的溶液:I﹣ NO3﹣SO42﹣Fe3+ Al3+ .
编号 | a的取值范围 | 产物的化学式(或离子符号) |
① | a≤ | I2Br﹣ |
② |
| I2Br﹣Br2 |
③ |
| I2 IO3﹣ Br2 |
④ | a≥ | IO3﹣ Br2 |
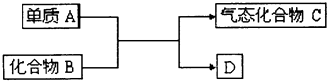
①此反应的化学方程式是.
②D单质的一种重要用途是.
①当有1molC生成时,该反应转移电子的总数是.
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为.
①该反应的化学方程式是.
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O.已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O.请写出发生反应的化学方程式:.
2SO2(g)+O2(g) 2SO3(g)
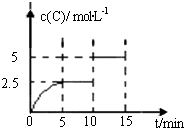
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.

①a、b两点对应的平衡常数K(a) K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a) c(b).
②c点时,反应速率v(正) v(逆) .
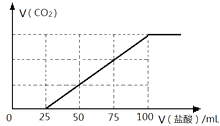
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e﹣所带电量为1.6×10﹣19C).
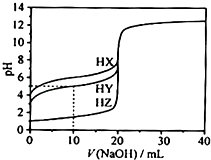
已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 酸 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2mol•L﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(﹣COOH)的反应.其中BAD结构简式为: 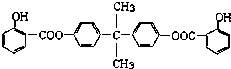
BAD的合成路线如下:
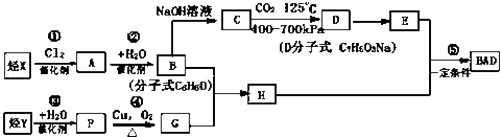
试回答下列问题:
①能发生银镜反应②遇FeCl3溶液显紫色③核磁共振氢谱图中有四个吸收峰.