 检查气密性
B .
检查气密性
B .  检验O2是否集满
C .
检验O2是否集满
C .  收集H2
D .
收集H2
D .  稀释浓H2SO4
稀释浓H2SO4


| 选项 | 实验目的 | 实验方法 |
| A | 除去MnO2固体中的KCl | 加水溶解,过滤,洗涤,干燥 |
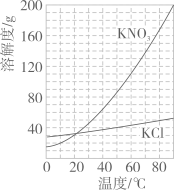
| B | 鉴别化肥NH4Cl和KNO3 | 取少量化肥加入熟石灰粉末研磨,闻气味 |
| C | 配制质量分数为6%的NaCl溶液 | 称取3.0g NaCl,加入50.0mL水使之溶解 |
| D | 鉴定本地雨水是否为酸雨 | 用pH计测定雨水的pH |

注:BaSO4难溶于盐酸;K2SO4、BaCl2的水溶液均呈中性。据此实验可知,固体A中的物质最多有( )
①小麦粉中富含的基本营养素是;
②肉馅中的蛋白质是由多种(填字母)构成的极为复杂的化合物。
a.维生素 b.无机盐 c.氨基酸
③铁强化酱油是常用的调味剂,长期食用可以预防(填字母)。
a.骨质疏松 b.贫血 c.甲状腺肿大
①下列物品中,由有机合成材料制成的是(填字母)。
a. ![]() 塑料油桶 b.
塑料油桶 b. ![]() 纯棉帽子 c.
纯棉帽子 c. ![]() 碳纳米管
碳纳米管
②C919飞机机身蒙皮使用了铝锂合金材料。下列不属于铝锂合金性质的是(填字母)。

a.密度大 b.硬度高 c.抗腐蚀
a.单质 b.氧化物 c.有机物
![]()
画出X分子的微观示意图:。

实验室中常用CO2→ CaCO3检验CO2气体,写出其化学反应方程式:。
I.可用下图所示方法自制汽水来消暑解热。

制汽水时, NaHCO3与柠檬酸反应生成柠檬酸钠、二氧化碳和水。
①据此推测,通常条件下不能与柠檬酸反应的物质是(填字母)。
a.镁带 b.氯化钠 c.烧碱
②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与有关。
Ⅱ.Al-CO2电池是一种新型电池。
③电池的工作原理:在O2的催化下,Al与CO2生化合反应生成Al2(C2O4)3。写出此反应的化学方程式:。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气

①该装置中仪器A的名称为。
②若过滤时滤液出现浑浊,可能的原因是(填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁

注:AgCl是白色固体,难溶于水和稀HNO3。
①乙中有无色无味气体产生,证明样品中含有Na2CO3。产生气体的化学方程式为。
②试剂X为溶液;可证明NaCl存在的现象是。

步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m2。
①球形干燥管中不用NaOH固体而用CaCl2固体的原因是。
②小明同学认为(m1-m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是。