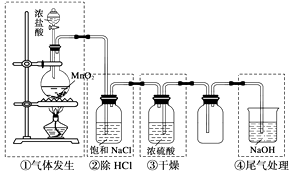
实验方法:将适量新制氯水加入到20mL富含溴离子的海水中(海水可以用01mol·L-1的溴化钠溶液代替),把溴置换出来
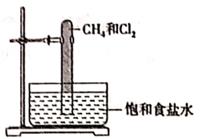
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是(填标号)
A.  B.
B. 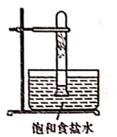 C.
C. 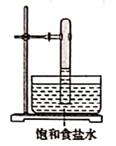 D.
D. 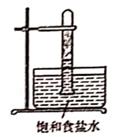
(查阅资料)
① ![]()
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
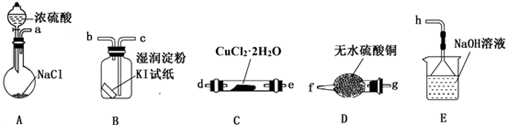
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
a. I与
I互为同位素
b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是。
II:在空气中点燃H2 , 然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测(填“正确”或“不正确”);理由是。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
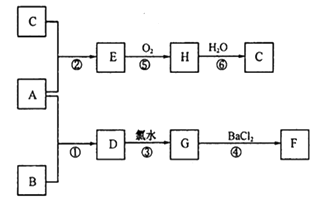
则:①A和B 分别为:A B;
②A与B发生反应的条件是;
③反应⑥的化学方程式为;
④上述反应中,不属于氧化还原反应的是。(填数字序号)。
|
实验操作 |
实验现象 |
结论 |
|
①用玻璃棒蘸取溶液,点在试纸上 |
试纸呈蓝色 |
c(OH-)>c(H+) |
|
②用玻璃棒蘸取溶液,点在试纸上 |
试纸不变色 |
|
|
③向实验②的试纸上滴加溶液 |
试纸呈蓝色 |
溶液中有IO3- |
| 选项 | 实验操作和现象 | 结论 |
| A | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 | X溶液中一定含有Fe2+ |
| B | 向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)> Ksp(AgCl) |
| C | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Br2的氧化性比I2的强 |
| D | 用pH试纸测得:CH3COONa溶液的pH约为 9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力比CH3COOH的强 |