




(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)

①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1

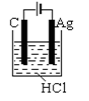 B .
B . 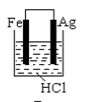 C .
C . 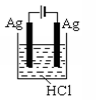 D .
D . 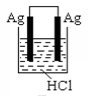

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-” 。
②写出表示丙烷燃烧热的热化学方程式:。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为。
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol(a)
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ/mol(b)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol(c)
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2 , 因此无法通过实验直接测得反应: C(s)+1/2O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有。

①图像中T1和T2的关系是T1T2(填“>”、“<”或“=”)。
②比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是(填字母)。

①a和b不连接时,烧杯中发生反应的离子方程式是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式是,Zn极发生(填“氧化”或“还原”) 反应,溶液中的H+移向(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻g。
①电池的负极是(填“a”或“b”) 电极,
该极的电极反应式为:。
②电池工作一段时间后电解质溶液的pH(填“增大”“减小”或“不变”)。

|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
() |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
|
V正=V逆 |