| 实验操作 | 实验现象 | |
| A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
| B | 将镁条点燃后迅速伸入集满 | 集气瓶中产生浓烟并有黑色颗粒产生 |
| C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
| D | 向盛有 | 黄色逐渐消失,加KSCN后溶液颜色不变 |

①它们既不是同系物,也不是同分异构体
②乙烷是饱和烃,乙烯、乙炔是不饱和烃
③乙烯、乙炔能使溴水褪色,乙烷不能使溴水褪色
④它们都能燃烧,乙炔燃烧火焰最明亮,有浓烟
⑤它们都能使酸性KMnO4溶液褪色
| A | B | C | D |
| | | | |
| 混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
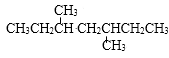 的单炔烃有( )
的单炔烃有( )

原料环己醇中若含苯酚杂质,检验试剂为,现象为。

①烧瓶A中进行的可逆反应化学方程式为,浓硫酸也可作该反应的催化剂,选择 而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料碳化并产生
b. 污染小、可循环使用,符合绿色化学理念
c.同等条件下,用 比浓硫酸的平衡转化率高
②仪器B的作用为。
在一定条件下,向 环己烯样品中加入定量制得的
,与环己烯充分反应后,剩余的
与足量
作用生成
,用
的
标准溶液滴定,终点时消耗
标准溶液
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
① ![]()
②
③
滴定所用指示剂为。样品中环己烯的质量分数为(用字母表示)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. 标准溶液部分被氧化

A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液

①E装置的作用。
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂,充分反应后进行操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是。

反应①的反应类型是。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式。
a.苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
b.苯和乙炔在空气中燃烧都有浓烟产生
c.苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
d.聚乙炔是一种有导电特性的高分子化合物
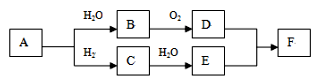
请回答: