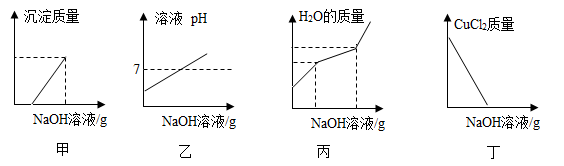
 测溶液pH值
B .
测溶液pH值
B .  塞紧胶塞
C .
塞紧胶塞
C .  收集氢气
D .
收集氢气
D .  取用大理石
取用大理石

 验证NaHCO3受热分解生成Na2CO3、H2O和CO2
B .
验证NaHCO3受热分解生成Na2CO3、H2O和CO2
B .  用托盘天平称量氢氧化钠
C .
用托盘天平称量氢氧化钠
C .  用酚酞试液鉴别碳酸钠溶液和石灰水
D .
用酚酞试液鉴别碳酸钠溶液和石灰水
D .  用排水集气法收集氧气
用排水集气法收集氧气

Ⅰ.将A分别滴入B、C、D、E中,均没有明显现象。
Ⅱ.将B分别滴入A、C、D、E中,C、E中均产生白色沉淀,其余没有明显现象。
Ⅲ.将C分别滴入A、B、D、E中,B中产生白色沉淀,D中有气泡冒出,其余没有明显现象。

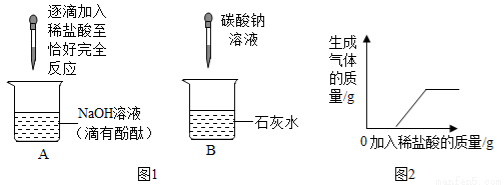
【作出猜想】猜想一:废液中,能使酚酞溶液变红的物质可能是氢氧化钠;
猜想二:废液中,能使酚酞溶液变红的物质还可能是;
猜想三:废液中,能使酚酞溶液变红的物质还可能是氢氧化钙;
【实验验证】同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到了如图2所示的图像。
【结论】分析图像数据得出,废液中使酚酞溶液变红的物质一定是,一定不是。
【拓展提高】为了使以上废液实现安全排放,你的做法。

①该方法中加热仪器名称是;
②推测:在硫酸溶液中加入氯化铵和对溶液加热,目的都是。
③思考图Ⅱ方法,你认为相比用稀盐酸和石灰石反应,其改进的出发点是。
提供的实验药品:锌粒、铁丝、硫酸锌溶液、稀H2SO4、FeSO4溶液。
方案一:
【提出问题,建立假设】我们的假设:活动性比较强的金属锌能把活动性较弱的金属铁从它的盐的水溶液中置换出来。
【设计实验方案】在盛有硫酸亚铁溶液的试管里加入洁净的(经过除油、除锈处理)锌粒,过一会儿取出。根据所提供的的实验药品,你也可以有其他的实验方案,与同学进行交流。
方案二:你的假设:;
【设计实验方案】设计的实验方案: ;
观察到的实验现象:;
根据以上实验事实,你的结论是;
用此方法探究其他金属的活动性,你觉得有什么不足之处,。(请写出两点)
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:
6ZnFe2O4 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
3ZnFe2O4+H2↑
2Mg2Cu+ 3H2 3MgH2+MgCu2
补充资料:MgCu2+HCl=MgCl2+Cu+H2↑
熔炼制备Mg2Cu合金时,通入氩气的目的是。
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量,数据如下表:
|
锥形瓶 |
锥形瓶+稀盐酸 |
锥形瓶+反应后溶液 |
|
|
质量(克) |
35.5 |
55.5 |
80.5 |

|
实验序号 |
第一次 |
第二次 |
第三次 |
第四次 |
|
加入稀硫酸质量(克) |
20 |
20 |
20 |
20 |
|
充分反应后剩余固体质量(克) |
m |
14.4 |
12.0 |
12.0 |
请分析回答下列问题:
|
实验步骤 |
实验操作 |
现象 |
|
一 |
取混合溶液100克,加入过量的氯化钡溶液 |
产生白色沉淀 |
|
二 |
滴加无色酚酞试液 |
红色 |
|
三 |
逐滴加入稀盐酸 |
无色 |
利用下列提供的资料和你所学知识,从微观角度分析实验步骤三中向混有BaCO3白色沉淀的NaOH溶液中直接滴加稀盐酸,为什么不会使BaCO3与稀盐酸反应而影响实验结果,原因是什么?
资料:
⑴沉淀物是处于晶体状态,晶体中的离子和分子都是固定在晶格中无法移动。
⑵酸、碱溶液中溶质电离出自由移动的离子,离子在溶液中处于高度分散状态。
⑶其他条件一定时,反应物间的接触面积越大,化学反应速率越快。
⑷其他条件一定时,反应物之间接触机会越多,化学反应速率越快。