| 反应物 | a+b | a+c | b+c | c+d | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
由上述现象可推知a、b、c、d依次是( )
①盐卤(含MgCl2) Mg(OH)2
MgCl2溶液
无水MgCl2
②铝土矿 AlO2-
Al(OH)3
Al2O3
③NH3 NO
NO2
HNO3
④NaCl溶液 Cl2
无水FeCl2
⑤S SO3
H2SO4
⑥SiO2 Na2SiO3溶液
H2SiO3
| 选项 | X | Y | Z |
| A | Na | NaOH | NaCl |
| B | Si | SiO2 | Na2SiO3 |
| C | Cl2 | HClO | NaClO |
| D | NO | NO2 | HNO3 |

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2

|
N2 |
O2 |
Ar |
CO2 |
|
-196℃ |
-183℃ |
-186℃ |
-78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是。
①制取氨气的化学方程式为;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为g。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①NH3与稀硫酸溶液反应的离子方程式为;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
②
④
①取少量白色固体粉末于烧杯中,加水搅拌,有白色不溶物,过滤,滤液呈无色透明状。
②取①的白色不溶物少量于试管中,加入足量稀硝酸,固体完全溶解,并有无色气泡产生。
③取②所得的溶液2 mL于试管中,滴入几滴稀硫酸,有白色沉淀产生。
④另取①得到的无色透明溶液少量于试管中,加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
①;
②;
③;
④。

①写出加入KMnO4溶液除铁的离子方程式:。
②流程中调节pH=5.4所加试剂X为(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由。

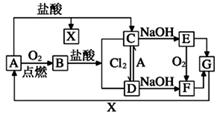

请回答下列问题:
