

①发热剂需接触到空气才会发热,原因是铁要与、等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是。
已知下列各组物质间均能发生置换反应。
A、Fe和CuSO4溶液
B、Mg和MnSO4溶液
C、Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式。

①紫红色固体C的化学式为。
②写出Ⅱ中反应的化学方程式。

[提出问题 铜在空气中长期放置会生锈吗?生锈的条件是什么?
查阅资料
铜在朝湿的空气中会慢慢生锈变绿,俗称铜绿,主要成分为碱式碳酸铜,化学式为Cu2(OH)2CO3
小组同学讨论认为仅完成甲、乙、丙三个实验不能得出实验结论,于是又用丁试管补充了一个实验,装置中除了铜片外,还应该加入。
[观察现象]放置两周后,发现甲中的铜片变绿了,乙丙丁中的铜片没变化。
甲和乙对比,得出的结论是铜生锈需要与接触。
乙和丙中使用的是煮沸后迅速冷却的蒸馏水,目的是。
(查阅资料)了解到这层锈渍的化学成分是碱式碳酸铜[Cu2(OH)2CO3],俗称“铜绿”。

①实验B的目的是。
②得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。
(提出问题)铜绿中除铜元素外还有其它什么元素?
(查阅资料)①无水硫酸铜遇水变蓝;②碳与一般的酸不反应。
(实验探究)该小组同学找到了一些铜绿并进行了如下实验:
![]()
Ⅱ处无水硫酸铜变蓝;
Ⅲ处澄清石灰水变浑浊,该处反应的化学方程式为。
(继续探究)取 I处冷却后的少量黑色固体于试管中,滴入足量的,若现象为:,则证明猜想(1)正确。

【查阅资料】①铜锈受热易分解②硫酸铜粉末遇水由白色变为蓝色
【进行实验】小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C 中澄清石灰水变浑浊。
【解释与结论】C中反应的化学方程式是。
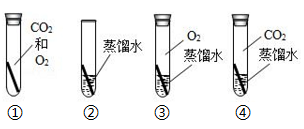
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示5个实验并持续观察。

【解释与结论】
实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
结合上述实验,你对保存铜制品的建议是。

(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
| 实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
| 实验操作 | | | |
| 实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
|
实验编号 |
所用试剂 |
实验现象 |
|
|
反应开始时 |
24h后 |
||
|
2-1 |
铁锈和2%盐酸 |
铁锈、溶液均无明显变化 |
铁锈消失,溶液变黄色 |
|
2-2 |
生锈铁钉和2%盐酸 |
生锈铁钉、溶液均无明显变化 |
铁锈消失,溶液变浅绿色 |
|
2-3 |
生锈铁钉和6%盐酸 |
铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 |
溶液变为浅绿色 |
|
2-4 |
生锈铁钉和10%盐酸 |
铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 |
溶液变为浅绿色 |
生锈铁钉与盐酸反应时,溶液的颜色变化与有关。
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
(知识回顾)铁生锈的条件为铁与、同时接触,为了防止铁制品生锈,应采取的措施是(写出一种)。
(提出问题)铁锈(Fe2O3•nH2O)中n的值等于多少呢?
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

实验前应先;

| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
铁锈(Fe2O3•nH2O)中n的值是;
