联合国将2019年定为“国际化学元素周期表年”,以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。

①CO2分子的空间构型及碳氧之间的成键方式;
②CO可以和很多金属形成配合物,如Ni(CO)4 , Ni与CO之间的键型为;
③乙烯的分子是C2H4 , 是根据其结构推断是分子(填 “极性”或“非极性”)
回答下列问题:


1mol甲酸分子中σ键与π键的比值为,甲酸和乙醇的熔点相差较大的主要原因是。


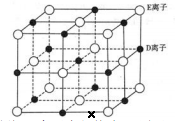
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有个 A 原子,该晶体的密度是g·cm-3(列式表示) 。

①B2H6分子结构如图,则B原子的杂化方式为
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是,写出一种与氨硼烷互为等电子体的分子(填化学式)。

磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是。

①X分子的立体构型是,中心原子杂化类型为,属于(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是。

①Cu+的配位数为,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是g•cm3(列出计算式)。