| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )

①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体
| 实验编号 | T/K | pH | c/10-3mol·L-1 | |
| H2O2 | Mn2+ | |||
| ① | 298 | 3 | 6.0 | 0.30 |
| ② | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 9 | 6.0 | 0.30 |
①生成物的质量分数一定增加 ② 任一生成物总量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率
①m的值为多少?
②A在5 min末的浓度。
③B的平衡转化率。
④该反应的平衡常数。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)25℃时,K=2.95×1011①
2CO(g)+4H2(g) CH3CH2OH(g)+H2O2(g)25℃时,K=1.71×1022②
根据表中数据分析:
|
温度(K)CO2/转化率(%)n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
22 |
①温度升高,K值(填“增大”、“减小”或“不变”)。
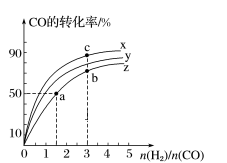
②提高氢碳比[n(H2)/n(CO2)],K值填“增大”、“减小”或“不变”),对生成乙醇(填“有利”或“不利”)
|
t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
|
c/mol/L |
0.050 |
0.036 |
0.030 |
0.026 |
0.022 |
0.017 |
0.016 |
0.015 |
0.015 |
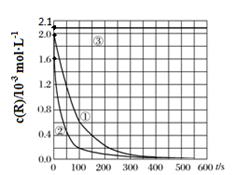
计算该反应在120~180s间的平均反应速率v(OH-)=;比较120~180s与180~240 s 区间的平均反应速率的大小,前者后者(填>,<或=),理由是:。

下图是反应CO(g)+2H2(g) CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①T1T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是(填字母)。
a. 降低温度
b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂
d. 充入He,使体系总压强增大