 C .
C . 
 D . 原子核内有8个中子的碳原子:
D . 原子核内有8个中子的碳原子:  和
和  互为同系物
互为同系物
|
实验 |
装置 |
试剂a |
现象 |
|
① |
|
Ca(OH)2溶液(含酚酞) |
溶液褪色,产生白色沉淀 |
|
② |
少量NaHCO3溶液 |
产生气泡 |
|
|
③ |
酸性KMnO4溶液 |
紫色溶液褪色 |
|
|
④ |
C2H5OH和浓硫酸 |
加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式错误的是( )
 ,下列有关该化合物的说法错误的是( )
,下列有关该化合物的说法错误的是( )
| 离子 | | | | | | | |
| 含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |





下列说法正确的是( )
 B .
B . 

请回答:
A 有机物D与金属钠反应比水与金属钠反应要剧烈
B 有机物C,D,E可用饱和Na2CO3溶液鉴别
C 实验室制备E时,浓硫酸主要起催化剂和脱水剂的作用
D 有机物D能使酸性KMnO4溶液褪色
①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应且能发生银镜反应
写出其中核磁共振氢谱为五组峰的物质的结构简式为。
 的合成线路(其它试剂任选)。
的合成线路(其它试剂任选)。
a.NH3·H2O是弱碱 b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7

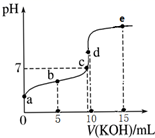
①表示滴定盐酸的曲线是(填序号)。若此实验选用酚酞为指示剂,则滴定到达终点的现象是。若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
d.碱式滴定管未用标准液润洗
②测定过程中使用到移液管,选出其符合题意操作并按序列出字母:蒸馏水洗涤→待转移溶液润洗→→→→→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口

已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
①迅速降至室温
②用玻璃棒摩擦器壁
③配制90℃的ZnSO4·7H2O溶液
④自然冷却至室温
⑤选规则明矾小晶体并悬挂在溶液中央
⑥配制高于室温10~20℃的ZnSO4·7H2O饱和溶液