
 B . 小气球变瘪
B . 小气球变瘪 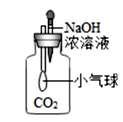 C . 验证Fe、Cu、Ag的金属活动性强弱
C . 验证Fe、Cu、Ag的金属活动性强弱  D . U型管内液面左高右低
D . U型管内液面左高右低 
 B . 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
B . 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸  C . 相同质量的镁、锌跟足量的稀硫酸反应制取氢气
C . 相同质量的镁、锌跟足量的稀硫酸反应制取氢气 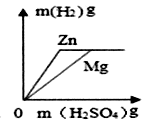 D . 在一定质量的稀硫酸中,逐渐加入氢氧化钡溶液
D . 在一定质量的稀硫酸中,逐渐加入氢氧化钡溶液 

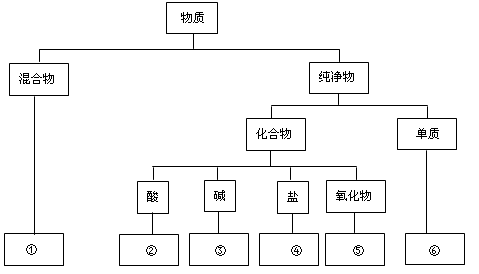
下列说法中正确的是( )
| 选项 | 物质 | 杂质 | 除去杂质的方法及试剂 |
| A | KCl固体 | MnO2 | 加入足量水溶解,过滤,蒸发结晶 |
| B | NaOH溶液 | Na2CO3 | 加入适量的盐酸,至恰好无气体 |
| C | CO2 | CO | 通过灼热的氧化铜粉末 |
| D | FeCl2溶液 | CuCl2 | 加入过量的铁粉,充分反应后过滤 |
①逸出气体若用碱石灰吸收,增重b克,则x偏小(碱石灰:CaO和NaOH的混合物)
②逸出气体若用碱石灰吸收,增重b克,则x偏大
③所得溶液蒸干并灼烧至恒重,得c克固体,灼烧时有固体飞溅出去,则x偏小
④所得溶液蒸干并灼烧至恒重,得c克固体,灼烧时有固体飞溅出去,则x偏大


 B . 铜导线
B . 铜导线 C . 铜火锅
C . 铜火锅

A~E中含铜、锌两种元素的物质有(填字母序号)。


A.空气 B.水分 C.铁丝的内部结构
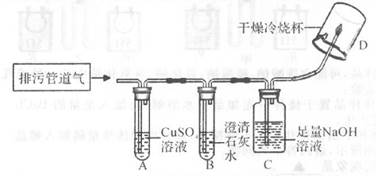
【提出问题】排污管道中的毒气有什么成分?
【查阅资料】
Ⅰ.排污管道中的大部分有机物在一定条件下发酵会产生CO、CO2、H2S、CH4等。
Ⅱ.H2S气体能与CuSO4 , 溶液反应生成黑色沉淀。
【提出猜想】小组同学对排污管道气含有上述气体中最少3种成分的猜想如下:
猜想1:有CO、CO2、H2S;猜想2:有CO、CO2、CH4;
猜想3:有CO、H2S、CH4;猜想4:有CO2、H2S、CH4;
猜想5:有CO、CO2、H2S、CH4。
【实验方案】小组同学共同设计了下图所示的装置并进行探究(夹持仪器已省略)。
【问题讨论】
① 称取100g干燥的茶叶,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后加入200mL盐酸,搅拌、过滤、洗涤。
② 向步骤①所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,再加热煮沸30min,过滤后得到滤液和沉淀。
③ 向步骤②所得的滤液中加入足量无水碳酸钠,充分搅拌,待充分反应后,过滤、洗涤,得到滤液和沉淀。请回答下列问题:
【提出假设】
假设一:可能含有氯化镁
假设二:可能含有镁粉
假设三:可能含有氢氧化镁
【查阅资料】①镁可与热水反应生成氢氧化镁;②氢氧化镁在水中溶解度很小,水溶液呈弱碱性。
【设计并进行实验】各取少量灰白色沉淀加入2支试管中,进行如下实验:
|
编号 |
实验操作 |
实验现象 |
|
实验1 |
加入一定温度的蒸馏水、搅拌 |
沉淀未见减少 |
|
实验2 |
加入适量稀盐酸 |
沉淀全部溶解,没有气泡产生 |
小组同学进行了如下实验:在小烧杯中加入一定量的稀盐酸和去除氧化膜的镁带,测量溶液pH的变化,并观察实验现象。结果如下表:
|
时间/min |
0 |
2 |
4 |
8 |
12 |
16 |
20 |
24 |
|
溶液pH |
2.0 |
5.3 |
7.0 |
8.6 |
9.3 |
9.8 |
10.0 |
10.0 |
|
实验现象 |
镁带溶解较快,产生大量气泡,试管温度升高,无沉淀生成 |
镁带缓慢溶解,产生气泡速率减慢,溶液变浑浊,烧杯底部有灰白色沉淀 |
||||||
根据表中信息,请你说说溶液pH值出现这样变化的原因:。
小明查阅了相关资料。
资料1:氧化亚铜是砖红色不溶于水的固体
资料2:氧化亚铜能与硫酸反应,化学方程式为Cu2O+H2SO4=Cu+CuSO4+H2O
于是,小明往试管中加入一些稀硫酸浸泡一段时间后,根据产生的现象得出结论:附着在试管内壁上的物质中含有氧化亚铜。
通过比较分析,试管内壁出现砖红色物质的原因可能是。
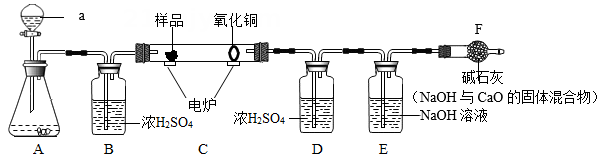

要求:通过计算并在图中标出曲线中必要的数据(计算结果保留1位少数)。
(Fe+CuSO4=FeSO4+Cu、Zn+CuSO4=ZnSO4+Cu)
![]()

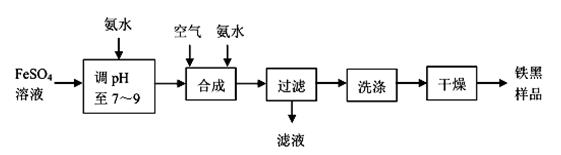
制取铁黑的反应原理可表示为:Fe(OH)2+2Fe(OH)3 Fe(OH)2·2Fe(OH)3
Fe3O4
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+ , 除去过量的Sn2+ , 再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加24.108mg/mL的K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O恰好完全反应时,共消耗50.00mLK2Cr2O7溶液。
求:
①50.00mL的K2Cr2O7溶液中Cr2O72-的质量.
②样品中Fe3O4的质量分数