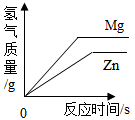
 B .
B . 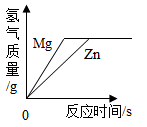 C .
C . 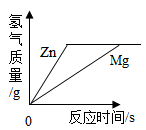 D .
D . 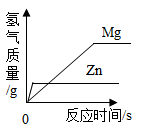
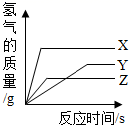


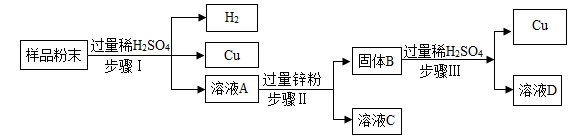
请回答:
(实验步骤)
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。
②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。
③小心的把三个气球分别套在各个试管口上,如图所示。
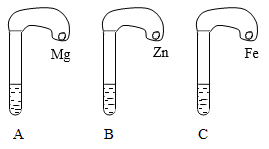
④分别将三种金属粉末倒入试管中。
(实验预测与分析)
(提出问题)铁、铜、银的金属活动性顺序是怎样的?
猜想一:Ag Fe Cu;
猜想二:Fe Cu Ag;
猜想三:

(收集证据)你认为实验①中应观察到的现象是
由此证明了探究三者的金属活动性顺序活动中猜想正确。
A.观察外观
B.检测其密度
C.放入MgCl2溶液中
D.在空气中加热
| 次数 | 1 | 2 | 3 |
| 加入稀硫酸质量/g | 50 | 50 | 50 |
| 剩余固体质量/g | 34.8 | 29.6 | 27.0 |
①第二次实验后剩余29.6g固体的成分是(填字母);
A.Cu
B. Zn
C.Cu和Zn
②样品中Cu的质量分数为%;
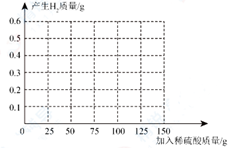
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
加入稀硫酸的质量(g) |
20 |
20 |
20 |
20 |
|
烧杯中剩余物的质量(g) |
39.92 |
59.84 |
79.80 |
99.80 |
|
产生氢气的总质量(g) |
0.08 |
0.16 |
0.20 |
m |