 B .
B . | 选项 | A | B | C | D |
| 装置或操作 | | | | |
| 预期目的 | 检验乙醇催化氧化产物中有乙醛 | 用于实验室里制备氨气 | 蒸干FeCl3溶液制备无水FeCl3 | 探究氧化性:KMnO4>Cl2>I2 |
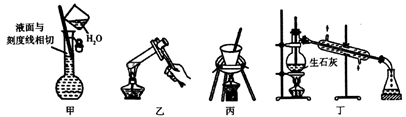
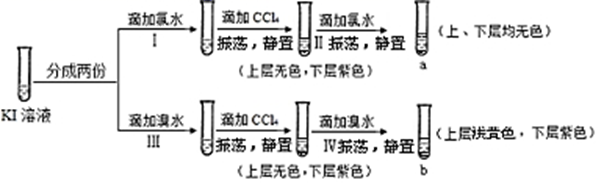
下列说法错误的是( )


①分离甲醇和水的混合物,所用的操作为。
②提取溴水中的Br2 , 所用的操作为。
③粗苯甲酸提纯,所用的操作为。

|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=(保留小数点后一位).
②上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母).
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
用托盘天平称量NaOH固体质量为g;
|
实验编号 |
c(NaOH) mol•L‒1 |
NaOH溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
|
1 |
0.10 |
25.90 |
20.00 |
|
2 |
0.10 |
26.00 |
20.00 |
|
3 |
0.10 |
26.10 |
20.00 |
滴定达到终点的标志是;


![]() +KMnO4→
+KMnO4→  + MnO2
+ MnO2
 +HCl→
+HCl→  +KCl
+KCl
| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL−1) | 溶解性 |
| 甲苯 | 92 | −95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
实验步骤:

①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
A.70% B.60% C.50% D.40%
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1 535 |
|
沸点(℃) |
2 467 |
2 750 |
某同学猜测,铝热反应所得到的熔落物是铁铝合金。理由:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?(填“合理”或“不合理”)。设计一个简单的实验方案,证明上述所得的熔落物中含有金属铝:

①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
请回答下列问题:
①NaBr+H2SO4=HBr+NaHSO4
②
A.H2O B.Na2SO3溶液 C.CCl4 D.NaOH溶液
除杂所需的主要玻璃仪器是(填仪器名称)
①加热:②加入AgNO3溶液:③加入稀HNO3酸化; ④冷却;⑤加入NaOH溶液
①配制2mL浓硫酸、3mL乙醇和2mL乙酸的混合榕液。
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min。

③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层。分离出乙酸乙酯,洗涤、干燥。